Металлы, расположенные в ряду напряжений (активности) от Li до Al получают путем электролиза расплава солей. Алюминий получают путем электролиза расплава Al2O3, который представляет собой соль Al[AlO3] и диссоциирует при расплавлении по схеме: Al[AlO3] → Al3+ + AlO 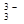 .
.
На катоде восстанавливается алюминий:
Катод: Al3+ + 3ē → Al0 – процесс восстановления,
окислитель
а на аноде окисляется атом О-2входящий в состав аниона AlO 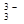 .
.
Анод: 4AlO 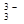 -12ē→3О2 +2Al2O3 – процесс окисления,
-12ē→3О2 +2Al2O3 – процесс окисления,
Суммарное уравнение электролиза:
 2Al[AlO3] электрический ток 4Al + 3O2
2Al[AlO3] электрический ток 4Al + 3O2
Остальные металлы чаще всего получают путем восстановления при взаимодействии их оксидов с каким-либо восстановителем (С, СО, Н2, Si, активные металлы): PbO + С → Pb + CO.
Если оксиды металлов в природе не встречаются, то их сначала получают путем термического разложения карбонатов металлов или окислением (обжигом) сульфидных руд по схемам:
MnCO3  MnO + CO2,
MnO + CO2,
(CuOH)2CO3  CuO + CO2 + H2O, или окисление (обжиг) сульфидов:
CuO + CO2 + H2O, или окисление (обжиг) сульфидов:
2CuS + 3O2 → 2CuO + 2SO2.
Неметаллы в промышленности получают несколькими путями – электролизом растворов и расплавов солей галогеноводородных кислот (хлор), путем восстановления из оксидов: SiO2 + 2Mg → Si + 2MgO, и другими способами.
 2017-11-01
2017-11-01 1842
1842








