Для достаточно разбавленных коллоидных растворов
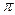 = (mo/m)RT/ VNA =
= (mo/m)RT/ VNA = 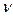 RT/ NA =
RT/ NA = 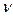 kT, (6.9)
kT, (6.9)
где mo – масса растворенного вещества, m – масса частицы, V – объем системы, NA – число Авогадро, 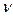 – частичная численная концентрация,
– частичная численная концентрация, 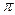 – осмотическое давление.
– осмотическое давление.
Для истинных растворов это уравнение имеет вид
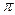 = moRT/MV = сRT/M,
= moRT/MV = сRT/M,
где М – молярная масса растворенного вещества, с – весовая концентрация.
Осмотическое давление лиозолей значительно ниже, чем у истинных растворов из-за малой величины частичной концентрации. Из-за явлений агрегации оно непостоянно. Агрегация и дезагрегация наступают в коллоидах под действием даже слабых воздействий извне.
Можно показать, что для дисперсной фазы одной и той же природы и весовой концентрации с, если r1 не равно r2, для двух систем



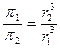
 (6.10)
(6.10)
Осмометрия применяется для определения молекулярной массы ВМС, образующих истинные растворы.
 2014-01-31
2014-01-31 723
723








