ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА КОЛЛОИДНЫХ СИСТЕМ
К электрокинетическим явлениям относятся электрофорез, электроосмос, потенциал седиментации и потенциал течения. Первые два явления открыты в 1808 г. Ф. Ф. Рейссом, вторые несколько позже: потенциал седиментации - Дорном в 1878 г. (иногда его называют эффектом Дорна), потенциал протекания - Квинке в 1859 г.
Электрофорезом называется движение частиц дисперсной фазы относительно дисперсионной среды под действием внешнего электрического поля. Электрофорез можно наблюдать в U-образной трубке, заполненной дисперсной системой с жидкой дисперсионной средой.
Если в U-образной трубке поставить кварцевую диафрагму, то при наличии внешнего электрического поля будет наблюдаться движение дисперсионной среды к отрицательному электроду. Это явление называется электроосмосом.
Оба явления обусловлены наличием заряда на поверхности раздела частица–жидкость или жидкость – мембрана.
Потенциал течения возникает при движении жидкости через пористую диафрагму под влиянием приложенной извне силы и распределяется по длине диафрагмы. Это явление по своей физической сути противоположно электроосмосу.
Потенциал седиментации возникает при осаждении частиц в гравитационном поле, распределяется по длине трубки и по своей сути противоположен электрофорезу.
По современным представлениям заряд коллоидных частиц лиозолей обусловлен существованием на их поверхности двойного электрического слоя, или сокращенно ДЭС, который возникает за счет избирательной адсорбции одного из ионов раствора или за счет ионизации поверхностных молекул вещества. Выглядит это следующим образом.
Пусть в растворе KI находятся кристаллы AgI. Иодид-ионы как потенциалопределяющие будут достраивать кристаллическую решетку частиц, заряжая их отрицательно. Противоионы калия находятся в растворе вблизи межфазной границы. Весь комплекс нейтрален, называется мицеллой и изображается в виде формулы [nAgImI-(m-x)K+]xK+.
Возникновение ДЭС по второму механизму происходит на частицах водного золя диоксида кремния. В этом случае диоксид гидратируется с образованием кремниевой кислоты, которая диссоциирует по схеме: H2SiO3 = SiO32- + 2H+.
Ионы водорода переходят в раствор, а поверхность заряжается отрицательно.
ДЭС обычно рассматривают как конденсатор, состоящий из двух обкладок, одна из них связана с дисперсной фазой, другая с дисперсионной средой.
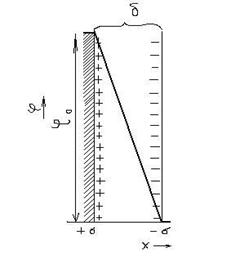 По теории Гельмгольца ДЭС – это плоский конденсатор, одна из обкладок которого находится на поверхности твердого тела, другая с противоположным зарядом - в жидкости. Падение потенциала в такой модели линейно. Схема такого слоя представлена на рис. 7.1.
По теории Гельмгольца ДЭС – это плоский конденсатор, одна из обкладок которого находится на поверхности твердого тела, другая с противоположным зарядом - в жидкости. Падение потенциала в такой модели линейно. Схема такого слоя представлена на рис. 7.1.
Рис. 7.1. Схема ДЭС по Гельмгольцу
Поверхностный заряд определяется по формуле
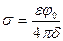 , (7.1)
, (7.1)
где e – абсолютная диэлектрическая проницаемость среды между обкладками, j0 – разность потенциалов между дисперсной фазой и раствором, d – расстояние между обкладками.
Позже появилась теория Гуи–Чэпмена, причем каждый из ученых предложил ее независимо от другого. По представлениям этой теории ДЭС состоит из плотной и диффузной частей. Диффузная часть возникает из-за теплового движения ионов, благодаря ее наличию падение потенциала в ДЭС имеет криволинейный характер.
На рис. 7.2 представлена схема строения ДЭС по Гуи–Чэпмену.
Число противоионов по мере удаления от границы раздела уменьшается в соответствии с законом распределения Больцмана и для точки с потенциалом jч определяется по формулам

С+ = С ¥ exp (-Fz jч /RT),
(7.2)
C- = C exp (Fz jч /RT),
где z – валентность иона, С+,С- – концентрация катиона и аниона, соответственно, С¥ – концентрация для точки j¥ = 0.
Линия АВ на рис. 7.2 – это граница скольжения при перемещении жидкой и твердой фаз. В этой точке реализуется потенциал z (дзета-потенциал), или электрокинетический потенциал. Именно этот потенциал определяет перемещение фаз при наложении электрического поля.
Если ввести в систему индифферентный электролит, то общий скачок потенциала не изменится. Однако при этом будет уменьшаться толщина диффузного слоя, так как для компенсации заряда потенциалопределяющих ионов требуется одно и то же число противоионов. Происходит сжатие ДЭС и меняется распределение в нем потенциала. Изменяется и дзета-потенциал, как это наглядно представлено на рис. 7.3.
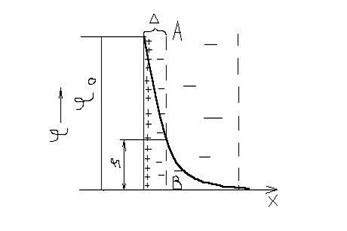
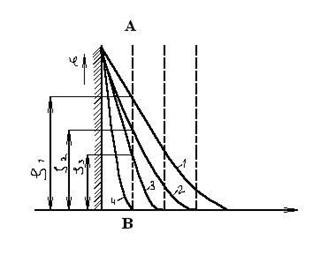
Рис. 7.2. Строение ДЭС по Гуи-Чэпмену Рис. 7.3. Влияние индифферентного электролита на толщину ДЭС и дзета-потенциал (концентрация электролита растет от 1 к 4)
При некоторой концентрации дзета-потенциал исчезает (кривая 4). Теория Гуи–Чэпмена не объясняет целый ряд фактов, таких как влияние многовалентных ионов, ионов разной природы на дзета-потенциал. Она неприемлема для концентрированных коллоидных растворов.
В 1924 году была предложена теория Штерна, которая объединила обе рассмотренные выше теории.
По Штерну, несколько первых слоев противоионов притягиваются к стенке под влиянием электростатических и адсорбционных сил, так что часть противоионов находится близко у поверхности и образует плоский конденсатор толщиной d. В этом слое, который часто называют слоем Гельмгольца, наблюдается резкое падение потенциала. Остальные противоионы образуют диффузную часть ДЭС, которую называют слоем Гуи.
 2014-01-31
2014-01-31 1113
1113








