ВВЕДЕНИЕ
Углеводороды имеют важное научное и практическое значение. Во-первых, представления о строении и свойствах этих вещества служат основой для изучения органических соединений других классов, т. к. молекулы любых органических веществ содержат углеводородные фрагменты. Во-вторых, знание свойств углеводородов позволяет понять исключительную ценность этих соединений как исходного сырья для синтеза самых разнообразных органических веществ, широко используемых человеком.
Углеводороды содержатся в земной коре в составе нефти, каменного и бурого углей, природного и попутного газов, сланцев и торфа. Запасы этих полезных ископаемых на Земле не безграничны. Однако до настоящего времени они расходуются главным образом в качестве топлива (двигатели внутреннего сгорания, тепловые электростанции, котельные) и лишь незначительная часть используется как сырье в химической промышленности. Так, до 85% всей добываемой нефти идет на получение горюче-смазочных материалов и лишь около 15% применяется как химическое сырье. Поэтому важнейшей задачей является поиск и разработка альтернативных источников энергии, которые позволят более рационально использовать углеводородное сырье.
Углеводороды
Углеводороды являются родоначальниками основных классов органических соединений, поэтому необходимо уделить особое внимание их изучению. При их рассмотрении необходимо заострить внимание на таких положениях, как: гомологический ряд, изомерия, номенклатура, углеводородный и свободный радикалы [1].
Углеводороды - класс простейших органических соединений, состоящий из углерода и водорода, подчиняющийся общей формуле СnНm.
При замещении атомов водорода на различные функциональные группы или радикалы получают самые разнообразные соединения, которые группируются в гомологические ряды, в которых каждый последующий гомолог отличается от предыдущего на группу СН2, называемую гомологической разностью.
Каждый гомологический ряд подчиняется общей формуле и имеет сходные химические свойства. Гомологи могут отличаться физическими свойствами - результат перехода количественных изменений в качественные.
Углеводороды в зависимости от строения углеродного скелета и характера связи между атомами углерода делятся на алканы (предельные), алкены, алкины, диеновые (непредельные), арены (циклические непредельные), алициклические (циклоалканы).
Многообразие углеводородов
В силу особенностей строения и свойств углерода его соединения с водородом весьма многочисленны и разнообразны. Это обусловлено рядом структурных факторов [3]:
· атомы углерода способны соединяться между собой в цепи различного
строения;
· даже при одинаковом количестве атомов углерода в молекулах углеводороды могут отличаться числом атомов водорода, например: молекулы с 4-мя атомами углерода могут содержать от 10-ти до 2-х атомов водорода;

· одному и тому же элементному составу молекул (одной молекулярной формуле) может соответствовать несколько различных веществ – изомеров. Например, структурные изомеры состава С4Н8;

2. Классификация углеводородов
Классификацию углеводородов проводят по структурным признакам, определяющим свойства этих соединений [1].
1. В зависимости от строения углеродной цепи углеводороды подразделяют на две группы:
· ациклические или алифатические, т. е. «жирные» (от греческого слова «алейфар» – «жир», т. к. впервые структуры с длинными углеродными цепями были обнаружены в составе жиров);
· циклические.

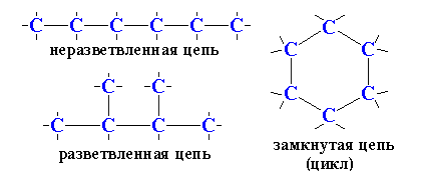
Открытая (незамкнутая) цепь алифатических углеводородов может быть неразветвленной или разветвленной. Углеводороды с неразветвленной углеродной цепью называют нормальными (н-) углеводородами.
Среди циклических углеводородов выделяют:
· алициклические (т. е. алифатические циклические);
· ароматические (арены).
В этом случае классификационным признаком служит строение цикла.
К ароматическим углеводородам относят соединения, содержащие один или несколько циклов С6Н6 (структура бензола).
2. По степени насыщенности различают:
o насыщенные (предельные) углеводороды (алканы и циклоалканы), в которых имеются только простые связи С С и отсутствуют кратные связи;
o ненасыщенные (непредельные), содержащие наряду с одинарными связями С С двойные или тройные связи (алкены, алкадиены, алкины, циклоалкены, циклодиены).
Алканы
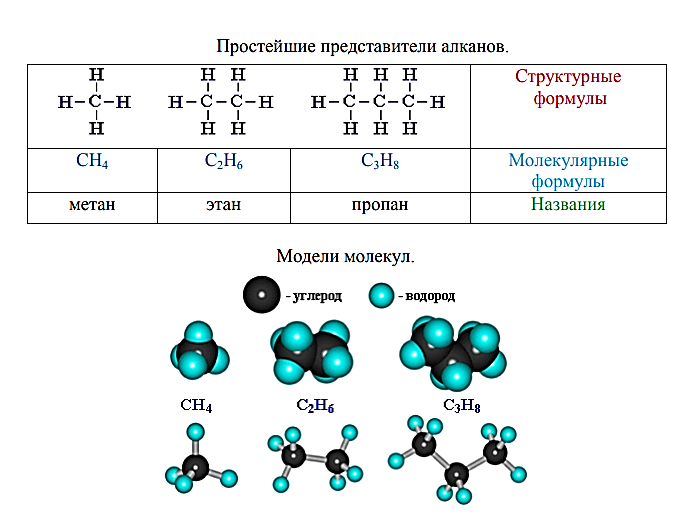
Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи [2].
Алканы – название предельных углеводородов по международной номенклатуре. Парафины – исторически сложившееся название, отражающее свойства этих соединений (от лат. parrum affinis – имеющий мало сродства, малоактивный). Предельными, или насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водородные смеси.

Основной источник алканов в природе нефть. Фракции нефти 200-430°С содержат 30-50% (по массе) алканов (из них до 60% углеводородов нормального строения).
Циклоалканы
Циклоалканы (циклопаpафины, нафтены, цикланы, полиметилены) – предельные углеводороды с замкнутой (циклической) углеродной цепью [3].
Атомы углерода в циклоалканах, как и в алканах, находятся в sp3–гибридизованном состоянии, и все их валентности полностью насыщены.
Простейший циклоалкан – циклопpопан С3Н6 – представляет собой плоский трехчленный карбоцикл.
Остальные циклы имеют неплоское строение вследствие стремления атомов углерода к образованию тетраэдрических валентных углов.
По правилам международной номенклатуры в циклоалканах главной считается цепь углеродных атомов, образующих цикл. Название строится по названию этой замкнутой цепи с добавлением приставки «цикло» (циклопропан, циклобутан, циклопентан, циклогексан и т. д.).
При наличии в цикле заместителей нумерацию атомов углерода в кольце проводят так, чтобы ответвления получили меньшие номера. Так, соединение следует назвать 1,2-диметилциклобутан, а не 2,3-диметилциклобутан, или 3,4-диметилциклобутан.
Молекулы циклоалканов содержат на два атома водорода меньше, чем соответствующие алканы. Напpимеp, бутан имеет фоpмулу С4Н10, а циклобутан – С4Н8. Поэтому общая формула циклоалканов СnH2n. Структурные формулы циклоалканов обычно изображаются сокращенно в виде правильных многоугольников с числом углов, соответствующих числу атомов углерода в цикле [4].
Таблица 1

Основной источник 5- и 6-членных алициклических соединений в природе нефть. Алициклические соединения входят как структурные фрагменты в молекулы многих природных соединений, например: циклопропан в пиретрины (природные инсектициды), циклопентан в простагландины (физиологически активные вещества), циклогексан в терпены (эфирные масла, смолы и др.).
Алкены
Алкены (этиленовые углеводороды, олефины) – непредельные алифатические углеводороды, молекулы которых содержат двойную углеродуглеродную связь. Общая формула ряда алкенов - CnH2n. 4.1. Строение двойной связи С=С Двойная связь С=С является сочетанием - и -связей (хотя она изображается двумя одинаковыми черточками, всегда следует учитывать их неравноценность). -связь возникает при осевом перекрывании sp 2 -гибридных орбиталей, а -связь – при боковом перекрывании р-орбиталей соседних sp 2 - гибридизованных атомов углерода. Образование связей в молекуле этилена можно изобразить следующей схемой: С=С -связь (перекрывание 2sp 2 -2sp2) и -связь (2рz-2рz), С–Н -связь (перекрывание 2sp 2 -АО углерода и 1s-АО водорода) [4].

Ծ-связи, образуемые sp 2 -гибридными орбиталями, находятся в одной плоскости под углом 120°. Плоскость - связи располагается под углом 90 к плоскости -связей. Поэтому молекула этилена имеет плоское строение.
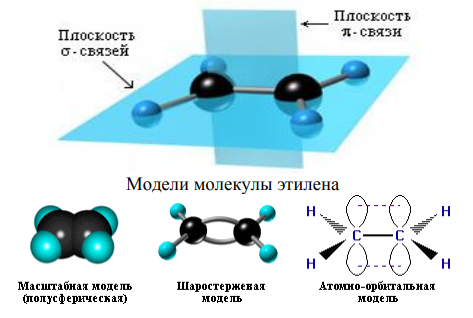

По своей природе - связь резко отличается от -связи: -связь менее прочная вследствие меньшей эффективности перекрывания р-орбиталей. В молекуле пропилена СН2=СН–СН3 в одной плоскости лежат 6 атомов: два sp 2 -гибридизованных атома углерода и четыре связанные с ними атома (3 атома Н и атом С группы СН3). Вне этой плоскости находятся атомы водорода в метильной группе СН3, имеющей тетраэдрическое строение, т. к. этот атом углерода sp 3 -гибридизован.

Аналогичное строение имеют другие алкены.
Алкадиены
Алкадиены (диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов СnH2n-2.
Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах. По этому признаку различают три типа двойных связей в диенах [5].
1. Изолированные двойные связи разделены в цепи двумя или более - связями: СН2=СН–СН2–СН=СН2
Разделенные sp3 -атомами углерода, такие двойные связи не оказывают друг на друга взаимного влияния и вступают в те же реакции, что и двойная связь в алкенах. Таким образом, алкадиены этого типа проявляют химические свойства, характерные для алкенов.
2. Кумулированные двойные связи расположены у одного атома углерода: СН2=С=СН2(аллен). Подобные диены (аллены) относятся к довольно редкому типу соединений.
3. Сопряженные двойные связи разделены одной -связью: СН2=СН–СН=СН2
Сопряженные диены представляют наибольший интерес. Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно непрерывной последовательностью 4-х sp 2-гибридизованных атомов углерода.
Отдельные представители этих диенов широко используются в производстве синтетических каучуков и различных органических веществ.
Алкины
Алкины (ацетиленовые углеводороды) – непредельные алифатические углеводороды, молекулы которых содержат тройную углерод-углеродную связь. Общая формула алкинов СnH2n-2 [2].
Простейшие представители:

Тройную связь  осуществляют 6 общих электронов:
осуществляют 6 общих электронов: 

В образовании такой связи участвуют атомы углерода в sp-гибридизованном состоянии. Каждый из них имеет по две sp-гибридные орбитали, направленные друг к другу под углом 180, и две негибридные р-орбитали, расположенные под углом 90 по отношению друг к другу и к sp-гибридным орбиталям.

Арены
Ароматическими углеводородами (аренами) называют циклическиесоединения, которые имеют общие признаки в строении и химических свойствах и объединяются понятием «ароматичность». Ароматичность – склонность вещества при явной ненасыщенности проявлять свойства насыщенных соединений [1]. Коричневую либо темно-бурую масляную жидкость со специфическим запахом ("каменное масло") уже в далекие времена люди научились использовать для получения битума и асфальта. Вавилоняне смешивали его с песком и волокнистыми материалами и применяли при сооружении зданий.
Народы Ближнего Востока использовали ее в светильниках вместо масла. Жидкую нефть применяли в качестве дезинфицирующей мази и как бальзамирующее вещество.
Классификация аренов может быть представлена следующей схемой:

 2020-08-05
2020-08-05 2110
2110







