При изучении этого материала следует усвоить современные взгляды на корпускулярно – волновое состояние электрона в атоме, вероятный характер распределения плотности электронного облака, значения квантовых чисел для энергетической характеристики состояния электронов в атоме, принцип Паули, правило Хунда и порядок заполнения электронных уровней, подуровней, орбиталей.
Практическая задача – умение составить электронную и электронно-графическую формулы атома, определять его возможные валентности и степени окисления по электронно-графическим формулам.
Строение атома
Атом – электронейтральная частица химического элемента, обладающая его химическими свойствами.
Атом состоит из положительно заряженного ядра, вокруг которого вращаются отрицательно заряженные электроны. Ядро каждого атома составляет его основу и определяет индивидуальные свойства элемента. Размер всего атома составляет примерно 10-8см, а размер ядра 10-13см, в ядре сосредоточена вся масса атома.
|
|
|
Согласно протонно-нейтронной теории, ядра всех атомов состоят из Z протонов (Z - равно порядковому номеру элемента в периодической системе
Д. И. Менделеева) и N нейтронов. Сумма числа протонов и числа нейтронов, содержащихся в ядре атомов каждого элемента, называется массовым числом атома, т.е. Ar=Z+N, поэтому число нейтронов равно N=Ar-Z.
Каждый элемент, как правило, представляет собой совокупность нескольких изотопов. Именно этим объясняется отклонение атомных масс многих элементов от целочисленных величин, т.к. атомная масса химического элемента есть средняя величина из атомных масс существующих изотопов с учётом распределения их в природе.
При всех химических процессах ядра атомов элементов, входящих в состав реагирующих веществ, не изменяются. Изменения претерпевают только электронные оболочки.
Исследования квантовой механики показали, что электрон обладает свойствами и частицы и волны. Двойственная природа электрона определяется уравнением Луи де Бройля λ=h/mν; где ν - скорость движения электронов, h-постоянная Планка.
В связи с двойственной природой электрона, его движение в атоме нельзя описать определённой траекторией, а можно лишь рассматривать определённый объём пространства, в котором находится электрон.
Для описания поведения электрона в атоме Э. Шредингер предложил дифференциальное уравнение, устанавливающее соотношение между энергией электрона и волновой функцией, определяющей плотность электронного облака. Волновую функцию или амплитуду электронной волны называют также атомной орбиталью или электронным облаком.
|
|
|
Для электронного облака атома водорода характерна сферическая форма, где на расстоянии 0,053 нм от ядра вероятность пребывания электрона максимальна. Околоядерное пространство, в котором с большой вероятностью может находиться электрон, называется атомной орбиталью (АО).
Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел. Они определяют размер (n), форму (l) и ориентацию атомной орбитали в магнитном пространстве (m l). Занимая ту или другую АО, электрон образует электронное облако. Формы электронных облаков аналогичны АО (рис. 1).

Рис.1. Формы электронных орбиталей
Главное квантовое число n характеризует энергию электрона и размеры орбитали, т.е. энергетический уровень орбитали. n принимает значения целых чисел от 1 до ∞ и определяется номером периода в периодической системе химических элементов Д. И. Менделеева. Совокупность электронов в атоме, обладающих одинаковым значением n, называют электронным слоем. Слои обозначают натуральным рядом цифр или букв.
| n | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Обозначение энергетическго уровня | K | L | M | N | O | P | Q |
Орбитальное квантовое число  определяет энергию электрона на подуровне и форму электронных орбиталей (рис. 1). Орбитальное квантовое число
определяет энергию электрона на подуровне и форму электронных орбиталей (рис. 1). Орбитальное квантовое число  принимает целочисленные значения от 0 до величины (n -1):
принимает целочисленные значения от 0 до величины (n -1):  =0, 1, 2, 3, 4 (n -1). Для n =1
=0, 1, 2, 3, 4 (n -1). Для n =1  =0; для n =2
=0; для n =2  = 0, 1; для n = 3
= 0, 1; для n = 3  =0, 1, 2 и т.д.
=0, 1, 2 и т.д.
Число подуровней в каждом энергетическом уровне равно его главному квантовому числу (табл. 3). Больше четырёх подуровней не заполняется, т.к. значения  =0, 1, 2, 3 описывают электроны в атомах всех известных элементов. АО, для которых орбитальное число принимают значения
=0, 1, 2, 3 описывают электроны в атомах всех известных элементов. АО, для которых орбитальное число принимают значения  =0, 1, 2, 3, соответственно называют s, p, d, f - орбиталями, а электроны, занимающие эти орбитали, соответственно s-, p-, d-, f – электронами.
=0, 1, 2, 3, соответственно называют s, p, d, f - орбиталями, а электроны, занимающие эти орбитали, соответственно s-, p-, d-, f – электронами.
Магнитное квантовое число m l характеризует магнитный момент и расположение электронных облаков в пространстве (см. рис. 1). Число возможных значений магнитного квантового числа при заданном  равно 2
равно 2  +1, при этом m l изменяется от – l через 0 до + l (см. табл. 1). Так если
+1, при этом m l изменяется от – l через 0 до + l (см. табл. 1). Так если  = 3 то m l имеет семь значений (2·3+1=7): -3, -2, -1, 0, +1, +2, +3.
= 3 то m l имеет семь значений (2·3+1=7): -3, -2, -1, 0, +1, +2, +3.
Спиновое квантовое число ms характеризует движение электрона вокруг своей оси как по часовой, так и против часовой стрелки, что условно обозначается +1/2 и - 1/2.
Энергетическое состояние электрона схематически обозначают в виде квантовых (энергетических) ячеек
электроны в этих ячейках обозначаются стрелками
| ↓↑ |
Это соответствует графической формуле распределения электронов в атоме гелия.
Следовательно, число состояний электрона в поле ядерных сил атома определяется четырьмя квантовыми числами: n,  , m
, m  , ms.
, ms.
Распределение электронов в атоме элементов по атомным орбиталям определяется принципом наименьшей энергии, принципом Паули и правилом Хунда.
1. Принцип наименьшей энергии. Правило Клечковского: последовательность размещения электронов по АО в невозбуждённом атоме должен отвечать наибольшей связи их с ядром, т.е. электрон должен обладать наименьшей энергией. Согласно этому правилу, электроны занимают уровни и подуровни в следующей последовательности:
1 s 2g2 s 2g2 p 6g3 s 2g3 p 6g4 s 2g3 d 10g4 p 6g5 s 2g4 d 10g5 p 6g6 s 2g4 f 14g5 d 10g6 p 6g
7 s 2g5 f 14g6 d 10g7 p 5, где s -, p -, d -, f - энергетические подуровни, цифры впереди буквы означают номер энергетического уровня, на котором находятся данные электроны, а индекс наверху справа показывает максимальное число электронов, которое может быть на данном подуровне.
Указанная последовательность заполнения электронами уровней и подуровней обусловлена принципом наименьшей энергии и правилом Клечковского: заполнение атомных орбиталей электронами происходит последовательно с ростом суммы квантовых чисел (n+ 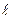 ), а при равенстве сумм этих чисел сначала заполняется тот подуровень, которому соответствует меньшее значение n.
), а при равенстве сумм этих чисел сначала заполняется тот подуровень, которому соответствует меньшее значение n.
|
|
|
Например, после 3 p подуровня будет заполняться 4s подуровень, для которого n=4, а 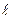 =0. Следовательно, ∑4+0=4. После 4 s 2 заполняется 3 d подуровень для которого n =3, а
=0. Следовательно, ∑4+0=4. После 4 s 2 заполняется 3 d подуровень для которого n =3, а 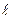 =2 (∑ n + l=3+2=5). Из таблицы 3 видно, что подуровню s соответствует орбитальное квантовое число
=2 (∑ n + l=3+2=5). Из таблицы 3 видно, что подуровню s соответствует орбитальное квантовое число 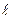 =0, d - соответствует
=0, d - соответствует 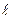 =2.
=2.
2. Принцип Паули: В атоме не может быть двух электронов, имеющих одинаковый набор всех четырёх квантовых чисел, т.е на АО могут находится не более двух электронов с противоположными спинами ↓↑. Согласно принципу Паули, максимальное число электронов на энергетическом уровне равно N=2n2 (см. табл. 3).
 2020-10-10
2020-10-10 197
197








