В титриметрическом анализе наибольшее применение имеют следующие способы выражения концентраций растворов.
Титр растворенного вещества Т(В) – этот масса растворенного вещества (В), содержащаяся в одном миллилитре раствора:
 ,
,
где m(B) – масса вещества, г;
VР – объем раствора, мл.
Титр измеряется в г/мл; в некоторых случаях – мг/мл или мкг/мл.
Молярная концентрация С(В) – количество растворенного вещества В, содержащееся в одном литре раствора:
 ,
,
где m(В) – масса растворенного вещества, г;
М(В) – молярная масса растворенного вещества, г/моль;
VР – объем раствора, л.
Молярная концентрация измеряется в моль/л, сокращенная форма записи единицы молярной концентрации М.
Зная титр растворенного вещества (Т(В)), можно рассчитать молярную концентрацию:
 .
.
Пример 1. Определите молярную концентрацию хлороводородной кислоты, если её титр равен 0,002302 г/мл.
Р е ш е н и е. Рассчитаем молярную концентрацию хлороводородной кислоты:
М(HCl) = 36,5 г/моль;
С(HCl) =  моль/л.
моль/л.
Концентрация растворов в титриметрическом анализе рассчитывается до четырех значащих цифр.
Молярная концентрация эквивалентов СЭКВ(В) – количество эквивалентов растворенного вещества В, содержащееся в одном литре раствора:
 ,
,
где m(В) – масса растворенного вещества, г;
М экв. (В) – молярная масса эквивалентов растворенного вещества, г/моль;
VР – объем раствора, л.
Молярная концентрация эквивалентов (С экв .) связана с титром растворенного вещества соотношением:
 .
.
Пример 2. 0,5312 г карбоната натрия Na2CO3 растворили в мерной колбе вместимостью 100 мл. Определите молярную концентрацию эквивалентов этого раствора.
Р е ш е н и е.
1) Вычисляют титр раствора:
 г/мл.
г/мл.
2) Находят молярную массу эквивалентов соли Na2CO3
 ,
,
Z – эквивалентное число.
Для карбоната натрия оно равно произведению валентности натрия (1) на число атомов натрия в одной молекуле:
Z (Na2CO3) = 2.
Следовательно,
 г/моль.
г/моль.
3) Рассчитывают молярную концентрацию эквивалентов карбоната натрия:
 моль/л.
моль/л.
Молярная концентрация эквивалентов измеряется в моль/л, сокращенное обозначение н (старое название молярной концентрации эквивалентов – нормальность).
Титр раствора по определяемому веществу Х, или титриметрический фактор пересчета – масса титруемого (анализируемого) вещества Х, взаимодействующая с одним миллилитром титранта Т. Измеряется, как и титр раствора, в г/мл, символ Т(Т/Х).
Титр раствора по определяемому веществу – величина, равная отношению произведения титра титранта на молярную массу эквивалентов определяемого вещества к молярной массе эквивалентов титранта:
Т(Т/Х) =  ,
,
где Т(Т/Х) – титр раствора по определяемому веществу, г/мл;
ТТ – титр титранта, г/мл;
М экв .(Х) – молярная масса эквивалентов анализируемого вещества, г/моль;
М экв .(Т) – молярная масса эквивалентов титранта, г/моль;
Отношение  называют титриметрическим множителем (фактором пересчета в титриметрии – FТ).
называют титриметрическим множителем (фактором пересчета в титриметрии – FТ).
Например,  г/мл. Найдем титр нитрата серебра по хлорид-иону:
г/мл. Найдем титр нитрата серебра по хлорид-иону:
 .
.
М экв .(Cl–) = 35,46 г/моль;
М экв . (AgNO3) = 169,9 г/моль.
Следовательно:
 г/мл.
г/мл.
Таким образом, 1 мл нитрата серебра с титром 0,001699 г/мл оттитровывает 0,0003546 г хлорид-ионов.
Зная титр по определенному веществу и объем титранта, израсходованный на титрование, можно рассчитать массу анализируемого вещества Х в растворе.
Например, если на титрование 20 мл раствора, содержащего хлорид-ионы, израсходовано 20,45 мл нитрата серебра с титром по хлорид-иону 0,0003546 г/мл, то, следовательно, а анализируемом растворе содержалось хлорид-ионов:
 ;
;
 .
.
В общем виде:
 ,
,
где m(Х) – масса анализируемого вещества в титруемом растворе, г;
Т(Т/Х) – титр титранта по определяемому веществу, г/мл;
V(Т) – объем титранта, израсходованный на титрование
анализируемого раствора, мл.
Стандартные растворы
Для проведения титриметрического определения необходим рабочий титрованный раствор (титрант), называемый стандартным раствором. По способу приготовления различают первичные и вторичные стандартные растворы.
Вещества, используемые для приготовления первичных стандартных растворов, называют первичными стандартными веществами (исходные).
Первичные стандартные вещества должны удовлетворять ряду требований.
1. Состав соединения должен строго соответствовать химической формуле. Оно либо выпускается промышленностью в высокочистом состоянии, либо легко подвергается очистке простыми методами, например, перекристаллизацией. Содержание примесей не должно превышать 0,05%, что примерно соответствует относительному стандартному отклонению при взвешивании навески.
2. Вещество должно быть устойчивым при комнатной температуре; вещества гигроскопичные, легко окисляющиеся атмосферным кислородом или поглощающие диоксид углерода непригодны. Вещество не должно претерпевать изменения при высушивании. Поэтому первичное стандартное вещество должно быть безводным и нелетучим. Можно использовать и кристаллогидрат, если его довести до определенной степени гидратации путем длительного выдерживания в атмосфере с постоянной относительной влажностью и затем сохранить эту степень гидратации во время взвешивания.
3. Вещество должно обладать по возможности большой молярной массой, чтобы уменьшить влияние неизбежной погрешности взвешивания.
4. Вещество должно быть доступным и безопасным в работе.
Первичный стандартный раствор (приготовленный) – раствор, приготовленный по точной навеске первичного стандартного вещества, растворенного в определенном объеме раствора. В титриметрическом анализе для приготовления первичных стандартных растворов применяют: буру – десятиводный кристаллогидрат тетрабората натрия Na2B4O7×10H2O; безводный карбонат натрия Na2CO3; гидрокарбонат калия KHCO3; дигидрат щавелевой кислоты H2C2O4×2H2O; дихромат калия K2Cr2О7 и др.
Расчет концентрации первичного стандартного раствора (первичный стандарт). Зная точную навеску вещества и объем раствора, вычисляют титр растворенного вещества.
Пример 1. Навеска тетрабората натрия составляет 1,8764 г, ее растворили в мерной колбе вместимостью 100 мл. Найти молярную концентрацию эквивалентов тетрабората натрия (бура).
Р е ш е н и е.
Дано: m(Na2B4O7 × 10H2O) = 1,8764 г, Vр-ра = 100 мл. Найти с экв(Na2B4O7×10H2O).
1). Находим титр: Т = 1,8764:100 =0,01876 г/мл.
2). Молярную концентрацию эквивалентов тетрабората в растворе находим по уравнению: 
Мэкв . (Na2B4O7 × 10H2O, z = 2) = 381,4:2 = 190,7 г/моль.
Сэкв .(Na2B4O7×10H2O) = (0,01876 × 1000):190,7 = 0,09837 моль/л.
Если вещества не удовлетворяют вышеуказанным требованиям, то из них готовят вторичные стандарты.
Вторичный стандартный раствор (стандартизированный, установленный) – раствор, концентрация которого устанавливается путем титрования первичным стандартным раствором (стандартизация).
Приготовление вторичного стандарта состоит из следующих операций:
1. Готовят первичный стандартный раствор нужной концентрации. Например, для стандартизации раствора хлороводородной кислоты готовят первичный стандарт из буры (Na2B4O7×10H2O).
2. Готовят раствор стандартизируемого вещества необходимой приблизительной концентрации. Для предыдущего примера – HCl.
3. Для уточнения концентрации вторичного стандартного (стандартизируемого) раствора проводят титрование первичного стандартного раствора вторичным или наоборот (процесс стандартизации).
Пример 2. Приготовить 250 мл 0,1 н раствора хлороводородной кислоты (раствор № 2) из имеющейся в лаборатории кислоты с плотностью 1,19 г/см3 (раствор № 1).
Р е ш е н и е.
Дано: V2(НСI) = 250мл; сэкв (HCl ) = 0,1н; р = 1,19г/см3. Найти V1 (НСI) =?
Зная плотность раствора, находят массовую долю хлороводородной кислоты: w(HCl) = 38%. Для приготовления 250 мл 0,1 н раствора HCl надо рассчитать необходимый объем 38%-ного раствора HCl.
1.Вычислим массу кислоты, необходимой для приготовления раствора
(в расчете на 100%-ный раствор HCl): m (HCl) = с экв × M экв × V р;
сэкв (HCl ) = 0,1 моль/л; М экв (HCl) = 36,5 г/моль; V р = 0,25 л;
m (HCl) = 0,1 × 36,5 × 0,25 = 0,9125 г.
2.Поскольку в лаборатории имеется раствор HCl с массовой долей 38%, то необходимо рассчитать массу раствора кислоты с w(HCl)=38%.
Из формулы 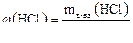 найдем массу раствора соляной кислоты с массовой долей 38%:
найдем массу раствора соляной кислоты с массовой долей 38%:  ,
, 
3. Рассчитаем объем 38%-ного раствора хлороводородной кислоты V 1, необходимый для приготовления 250 мл 0,1 н раствора:
V 1 =  мл.
мл.
Следовательно, для приготовления 250 мл 0,1 н раствора хлороводородной кислоты необходимо 2 мл концентрированной кислоты с массовой долей 38%. Приготовленный раствор будет иметь приближенную концентрацию.
Для уточнения концентрации раствора проводят стандартизацию его первичным стандартом.
По данным титрования рассчитывают точную концентрацию вторичного стандарта по уравнению титриметрии:
сэкв (HCl) × V (HCl) = сэкв (Na2B4O7) × V (Na2B4O7)
Стандартизированный раствор НСI можно использовать для стандартизации растворов щелочей и других веществ. Любой стандартный раствор дает возможность последовательно установить титры всех необходимых растворов, поэтому приготовление исходного титранта всегда требует особенной тщательности. Ведь точность титра исходного раствора определяет собой точность титров установленных по нему растворов, и, следовательно, точность титриметрического определения. Чтобы уменьшить эти погрешности, титр раствора устанавливают по возможности в таких же условиях, какие будут при выполнении анализа.
Иногда в практике технического и агрохимического анализа титрованные растворы готовят из стандарт-титров (фиксаналов). Стандарт-титр – это запаянная стеклянная ампула с количеством вещества, необходимым для приготовления 1 л точно 0,1 н или 0,001 н раствора.
Содержимое ампулы количественно переносят в мерную колбу вместимостью 1 л и доводят водой до метки. Для этого в горло колбы вставляют воронку и вкладывают стеклянный боек, о который разбивают дно ампулы. Затем стеклянной палочкой пробивают отверстие в верхней части ампулы и дают содержимому ее полностью вытечь или высыпаться в колбу. Через образовавшееся отверстие ампулу тщательно ополаскивают водой из промывалки. После этого обмывают воронку, убирают ее и доводят объем раствора в колбе водой до метки.
При правильном хранении титрованные растворы служат несколько месяцев, не изменяя своей концентрации.
 2020-10-10
2020-10-10 359
359








