Атомная физика
План
- Доказательства сложной структуры атома.
- Модель атома Томсона.
- Эксперимент Резерфорда. Планетарная модель атома.
- Слабые стороны планетарной модели.
- Спектральные серии атома водорода. Формула Бальмера-Ридберга.
- Квантовые постулаты Бора.
- Объяснение происхождения линейчатых спектров.
- Доказательства сложной структуры атома.
К началу ХХ века было накоплено достаточно фактов и доказательств сложной структуры атомов:
1) Опыты по электролизу Фарадея (1833 г.) наводили на мысль о существовании заряда, откуда следовало, что должен быть и носитель. Ведь при выделении одного моль одновалентного вещества, через электролит проходит заряд q, а если вещество 2-х валентно, то заряд удваивался.
2) Из периодического закона Менделеева (1869 г.) следовало, что увеличение массы атомов химических элементов связано с увеличением числа частиц.
3) Опыты Томсона по фотоэффекту (1897 г.) привели к открытию электрона – одной из составных частей атома.
4) Открытие линейчатых спектров (Волластон, Фраунгофер, Кирхгофф и Бунзен – в разные годы от 1802 г. до 1859 г.) приводило к мысли о структуре атома
|
|
|
5) Открытие радиоактивности Беккерелем (1896 г.) так же говорили о том, что в атоме что-то есть.
2.  Модель атома Томсона
Модель атома Томсона
Естественно, возникли попытки описать структуру атома. Одной из моделей, просуществовавшей с 1904 г. до 1911 г. была капельная модель Томсона, согласно которой атом представлял собой положительно заряженную капельку с плавающими в ней электронами. Модель хорошо описывала излучение света колебаниями электронов, что соответствовало электромагнитной теории Максвелла. В остальном было много вопросов без ответов. Модель прекратила своё существование после эксперимента Резерфорда.
3. Эксперимент Резерфорда. Планетарная модель атома.
Резерфорд поставил свой эксперимент, который позволил доказать ущербность модели Томсона и сформулировать планетарную модель атома. Здесь он не был оригинален – такая модель уже «гуляла» в умах учёных, но Резерфорд практически обосновал её жизнеспособность. Сущность эксперимента заключалась в следующем: очень тонкую золотую фольгу Резерфорд облучал потоком α-частиц с высокой энергией (6-7) МэВ (в миллион раз больше, чем энергия ионизации или энергия фотонов в фотоэффекте!) (Рис. 2). Согласно модели атома Томсона эти частицы должны были вязнуть в капельках атома (обладали же они массой, в конце концов!), но α-частицы вязли только в толстой фольге, а фольгу тонкую они прошивали, но угол рассеяния никак не согласовывался с моделью атома Томсона. Вопросов возникло сразу несколько:
|
|
|
- если атом Томсона «рыхлый», то α-частица его должна разбивать, теряя энергию, и рассеяние должно иметь равномерный характер;
- если атом Томсона жёсткий, то α-частица должна отскакивать – ведь атом золота во много раз тяжелее.
 Однако, рассеяние на линии движения было незначительным, а примерно одна из 8000 частиц отскакивала, как горох от стенки. Вот эти вопросы, да немного расчётов позволили Резерфорду сформулировать планетарную модель:
Однако, рассеяние на линии движения было незначительным, а примерно одна из 8000 частиц отскакивала, как горох от стенки. Вот эти вопросы, да немного расчётов позволили Резерфорду сформулировать планетарную модель:
- положительные и отрицательные частицы в атоме разделены;
- в центре – положительно заряженное ядро (никто не знал – что там), а отрицательные, электроны (это уже было известно), на периферии, возможно на орбитах, которые определяют размеры атома;
-  почти вся масса атома сосредоточена в небольшом, по меркам атома Томсона, ядре (Резерфорду пришлось уменьшить ядро в сто тысяч раз! Только такие размеры позволили бы весьма сконцентрированному положительному заряду отбросить α-частицу своим электрическим полем.
почти вся масса атома сосредоточена в небольшом, по меркам атома Томсона, ядре (Резерфорду пришлось уменьшить ядро в сто тысяч раз! Только такие размеры позволили бы весьма сконцентрированному положительному заряду отбросить α-частицу своим электрическим полем.
По этой модели оказывалось, что α-частицы летят почти через пустое пространство с редким расположением ядер, и для искривления траекторий нет причин (электроны, ввиду малости масс, не могли существенно повлиять на полёт). Если α-частица пролетала вблизи ядра атома золота, то испытывала возмущение в той или иной степени, что фиксировалось на экране. Если же α-частица испытывала центральный удар (или близко к этому), то согласно и закону сохранения энергии и закону сохранения импульса, отбрасывалась в противоположном направлении. Выше сказанное иллюстрируется на Рис. 2.
4. Слабые стороны планетарной модели
Новая модель подверглась критике:
- Невозможно было объяснить устойчивость такой системы – ведь летающий по орбите электрон должен излучать свет (так уж следовало из электродинамики Максвелла, идеи которой используются и развиваются до сих пор). Ну а излучающий электрон теряет энергию и должен упасть на ядро – материя перестаёт существовать в том виде, в котором… существует!
- Возникали вопросы относительно излучения света и формы атома;
- Не давали результата формулы механики для описания движения электрона в атоме т.д.
5. Спектральные серии атома водорода. Формула Бальмера-Ридберга.
Особо следует остановиться на проблемах излучения света, а то, что именно атом ответственен за данное явление, сомнению не подлежало. Со времён Ньютона было известно разложение белого света в спектр – на семь цветов радуги. Явление это называют дисперсией, и изучалось оно многими исследователями. Но в 1802 г. врач Волластон заметил на этом спектре солнечного излучения тёмные линии, беспорядочно расположене, но всегда в одном и том же месте. Линии эти были названы фраунгоферовыми, т.к. именно Фраунгофер детально их исследовал и описал, используя попутно для шлифовки стекол телескопов. Позже эти открытия легли в основу спектрального анализа, который заложили Кирхгофф и Бунзен в 1859 г. После этого секрет тёмных линий в спектре излучения Солнца был разгадан – это был спектр поглощения. Атмосфера Солнца (солнечная корона) освещена изнутри раскалённым ядром, и в ней поглощались те частоты из сплошного спектра горячего ядра, которые соответствовали спектральным линиям, находящихся в атмосфере химических элементов. Длины волн спектральных линий измерялись, сводились в таблицы, но дело было не в этом, а в том, что никто не мог ответить на вопрос – чем определяется порядок расположения линий в спектре. Но в 1885 г. школьный учитель Бальмер (некогда занимавший, между прочим, должность профессора философии в университете) вдруг записал формулу, по которой можно было рассчитать длину волны любой линии в спектре! Вот эта формула:
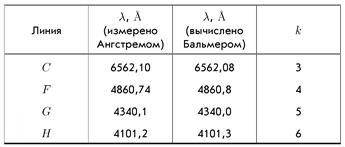
 , где b = 3645,6 Ǻ – некая постоянная Бальмера, а k – просто любое целое число, начиная с числа 3. Оказалось, что за порядок линий в спектре отвечает какое-то целое число! Вот это и обрушало мозг исследователям! Какая-то великая тайна природы была скрыта за этими целыми числами! В таблице приведены значения длин волн, рассчитанные по формуле Бальмера и измеренные Ангстремом (именно в честь него названа единица длины ангстрем; 1Ǻ = 10-10 м, диаметр атома водорода – 0,529Ǻ). В 1890 г. Ридберг усовершенствовал формулу Бальмера, записав её для частоты и сделав более универсальной:
, где b = 3645,6 Ǻ – некая постоянная Бальмера, а k – просто любое целое число, начиная с числа 3. Оказалось, что за порядок линий в спектре отвечает какое-то целое число! Вот это и обрушало мозг исследователям! Какая-то великая тайна природы была скрыта за этими целыми числами! В таблице приведены значения длин волн, рассчитанные по формуле Бальмера и измеренные Ангстремом (именно в честь него названа единица длины ангстрем; 1Ǻ = 10-10 м, диаметр атома водорода – 0,529Ǻ). В 1890 г. Ридберг усовершенствовал формулу Бальмера, записав её для частоты и сделав более универсальной:
 , где с = 3·108 м/с – скорость света, R = 1,097·107 м-1 – постоянная Ридберга для атома водорода, n и k – целые числа, причём, число n пробегает значения от единицы, а число k – от n+1.
, где с = 3·108 м/с – скорость света, R = 1,097·107 м-1 – постоянная Ридберга для атома водорода, n и k – целые числа, причём, число n пробегает значения от единицы, а число k – от n+1.
|
|
|
Из этой формулы получается формула Бальмера при n = 2, а её универсальность в том, что он позволяет вычислить частоту (длину волны) не только в видимой части спектра (как у Бальмера), но и в ультрафиолетовой, и в инфракрасной. Таким образом, возникли спектральные серии атома водорода, которые определялись числом n:
- n = 1 – ультрафиолетовое излучение (серия Лайман);
- n = 2 –видимое излучение (серия Бальмера);
- n = 3 – инфракрасное излучение (серия Пашена);
- n = 4 – инфракрасное излучение (серия Брэккета);
- n = 5 – инфракрасное излучение (серия Пфунда).
Теперь стало возможным рассчитывать все частоты, которые мог излучать атом водорода, а формула оказалась ключиком в мир атома. Но великий замысел природы, связанный с простыми числами был неясен. Другими словами – за дверью оказалась ещё дверь, и требовалось время, чтобы подобрать к ней ключ. Самое интересное, что в 1900 г. этот ключ был найден Планком – им оказалась квантовая идея, но этого вначале никто не осознал. Потребовалось ещё 13 лет и гений Нильса Бора, который этим ключом и воспользовался.
- Квантовые постулаты Бора.
Вспомним, что модель атома Резерфорда не отвечала на вопрос устойчивости атома. Однако Бор исходил не из устройства модели, а из реального положения вещей.
- И первый постулат гласил о том, что атом может находиться в стационарных состояниях, в которых он не излучает. Это противоречило модели, но не противоречило природе.
|
|
|
- Второй постулат гласил, что атом излучает или поглощает квант энергии (вот она – квантовая идея Планка, стрельнула!) при переходе из одного стационарного состояния в другое, а энергия излученного (или поглощённого) фотона равна разности энергий стационарных состояний атома (в полном согласии с законом сохранения энергии):
hν = Ek – En,
где hν – энергия фотона, Ek и En – энергия атома в стационарных состояниях.
Этот постулат тоже не подчинялся никаким, ранее открытым законам (ну, на то он и постулат!).
- В третьем постулате опять выстреливает квантовая идея Планка о дискретности энергии, но на этот раз дискретность получает орбитальный момент электрона, который Бор объявляет квантованным:
 ,
,
где me – масса электрона, ve – скорость электрона, r – радиус орбиты электрона, h – знаменитая постоянная Планка, а n – целое число (1, 2, 3, …) – тот самый «ключ» из формулы Бальмера-Ридберга! Вот так, совершенно непостижимым образом, в обычной формуле механики вращения вдруг появляются 1)атрибут квантовой идеи Планка и 2)какое-то целое число с совершенно непонятным физических смыслом из формулы Бальмера-Ридберга. Это число n получило название главного квантового числа
 Что получается – одной рукой Бор принимает идею вращения электрона по орбите (ведь в формуле есть её радиус), а второй рукой эту же идею отвергает, заменив понятие орбиты (да и сложно это считать орбитой, хотя химики и зовут это состояние орбиталью) на энергию. Т.е. атом получает формальное описание в виде энергетических уровней, что нисколько нас не приближает к сути «атом» – за второй дверью оказалась третья… На Рис. 3 проиллюстрировано излучение света атомом: а) фотон излучается, когда атом переходит с одной стационарной орбиты на другую, б) фотон излучается, когда атом переходит с одного энергетического уровня на другой).
Что получается – одной рукой Бор принимает идею вращения электрона по орбите (ведь в формуле есть её радиус), а второй рукой эту же идею отвергает, заменив понятие орбиты (да и сложно это считать орбитой, хотя химики и зовут это состояние орбиталью) на энергию. Т.е. атом получает формальное описание в виде энергетических уровней, что нисколько нас не приближает к сути «атом» – за второй дверью оказалась третья… На Рис. 3 проиллюстрировано излучение света атомом: а) фотон излучается, когда атом переходит с одной стационарной орбиты на другую, б) фотон излучается, когда атом переходит с одного энергетического уровня на другой).
Теперь уместно изобразить энергетическую схему атома водорода по Бору со спектральными сериями (Рис.4)

Очень удобная схема. Горизонтальные линии – уровни энергии, вертикальные линии со стрелочками – переход атома из одного энергетического состояния в другое. Если стрелка вниз – атом излучает, если вверх – поглощает квант энергии. Длина вертикальной стрелочки пропорциональна частоте и энергии фотона и обратно пропорциональна длине волны. Например, самая большая стрелочка в серии Лаймана – это фотон с наибольшей энергией (с максимально возможной частотой и минимально возможной длиной волны соответсвтенно), который способен излучить атом водорода и который получается при n = 1 и k = ∞. Его частота по формуле Бальмера-Ридберга равна:
 = 3,29·1015 Гц. Умножив это число на постоянную планка легко найти энергию фотона (Eф = hν), а разделив скорость света на это число – длину волны (
= 3,29·1015 Гц. Умножив это число на постоянную планка легко найти энергию фотона (Eф = hν), а разделив скорость света на это число – длину волны ( ). А как перевести атом в возбуждённое состояние, возвращаясь из которого он излучит тот или иной фотон? Есть много способов, но в основном, это взаимодействие с фотоном или элементарной частицей (банальный удар). Разумеется, энергия частицы или фотона должна быть достаточна, чтобы «перебросить» атом на другой энергетический уровень. А если энергия частицы или фотона при бомбардировке атома окажется больше энергии самого высокого уровня (при n = ∞), что произойдёт? Это очень просто – ионизация – электрон просто будет выбит из атома! Итак, атом будет излучать, если его возбудить тем или иным способом, которые мы, впрочем, уже изучали в теме «Излучение и спектры».
). А как перевести атом в возбуждённое состояние, возвращаясь из которого он излучит тот или иной фотон? Есть много способов, но в основном, это взаимодействие с фотоном или элементарной частицей (банальный удар). Разумеется, энергия частицы или фотона должна быть достаточна, чтобы «перебросить» атом на другой энергетический уровень. А если энергия частицы или фотона при бомбардировке атома окажется больше энергии самого высокого уровня (при n = ∞), что произойдёт? Это очень просто – ионизация – электрон просто будет выбит из атома! Итак, атом будет излучать, если его возбудить тем или иным способом, которые мы, впрочем, уже изучали в теме «Излучение и спектры».
К сожалению, этот простой способ использования механики вращения не позволил описать атомы других химических элементов, и потребовались ещё годы и годы и упорный труд целой плеяды гениальных учёных, чтобы был подобран ключик к следующей двери, ведущий к пониманию сущности атома.
7. Объяснение происхождения линейчатых спектров.
На основании квантовых постулатов Бора легко понять – почему атом каждого химического элемента имеет строго определённый набор спектральных линий. Всё, видимо, зависит от энергетической «лестницы», которая у атома каждого элемента своя. А набор излучаемых частот зависит от этой энергетической лестницы. Частота излучения атома не может быть произвольной – она определяется набором его энергетических уровней! Так уж устроена природа. Почему??? Надо искать…
Продолжение следует. Надо же понять, что такое spdf и какой он, всё-таки, образ атома!
Для просмотра роликов по теме можно воспользоваться ссылками
https://resh.edu.ru/subject/lesson/3910/main/48351/ атом Резерфорда
https://resh.edu.ru/subject/lesson/5908/main/197855/ постулаты Бора
§ 93-95 Физика11 Мякишев, Буховцев.
Задачи для самостоятельного решения.
1. Атом водорода возбудили до 5 уровня. Переходя последовательно на 2-й и 1-й уровни, атом излучил два фотона. Рассчитайте энергию, частоту излучения и длину волны этих фотонов. К какому виду излучений они относятся?
2. С какой скоростью должен лететь электрон, чтобы ударом перевести атом водорода с третьего энергетического уровня на пятый?
3. Рассчитайте максимальную длину волны фотона в серии Брэккета.
4. Атом водорода перешёл с 8-го уровня на 3-й. Рассчитайте длину волны и энергию излученного фотона.
 2020-10-10
2020-10-10 218
218






