Получение железа и чугуна. Чистое железо получают восстановлением водородом оксида железа(III) или хлорида железа(II):
Fе2O3 + 3 Н2 = 2 Fe + 3 Н2О, FeCl2 + Н2 = Fe + 2 HCl.
Основная масса железа используется не в чистом виде, а в виде сплавов с углеродом и другими добавками. Эти сплавы называются чугуном или сталью. Для получения чугуна и сталей перерабатывают железный руды, содержащие железо в виде оксидов. Сульфидные руды непригодны для получения железа, так как сера переходит в железо и придает ему свойство горячеломкости.
Процесс переработки железных руд делится на первичный и вторичный. При первичной переработке из железной руды получают чугун. С содержанием углерода больше 2%, а при вторичном. из чугуна получают сталь с содержанием углерода меньше 2%.
Первичный процесс, т. е. получение чугунов, производится в доменных печах (домнах).
Доменный процесс заключается в восстановлении железа из его оксидов и удалении серы и фосфора, вызывающих горячеломкость (сера) и холодноломкость (фосфор). Для восстановления железа из оксидов используют кокс. Извлечение серы и фосфора производят оксидом кальция, образующим с серой и оксидами фосфора соли. Этот процесс протекает эффективнее, если реагирующие вещества находятся в расплавленном состоянии Так как оксид кальция имеет очень высокую температуру плавления, используют смесь природного известняка (который при высокой температуре разлагается с образованием оксида кальция и углекислого газа) и песка — флюс. Смесь, содержащая оксид кальция, песок и силикат кальция, плавится при более низкой температуре, чем оксид кальция.
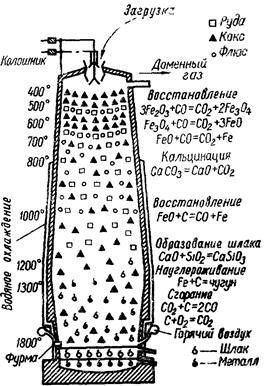
Рис. 14.1. Схема доменного процесса
Смесь руды, кокса и флюсов называется шихтой. Ее составляют так, чтобы получилось железо с наименьшим содержанием серы и фосфора.
Доменная печь — сложное сооружение высотой более 30 м, с внутренней обкладкой (футеровкой) из огнеупорного кирпича и стальным внешним кожухом. Конструктивно домна имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть домны называется шахтой, верхнее отверстие — колошником, средняя, самая широкая часть — распаром нижняя — горном. В верхней части горна расположены отверстия для вдувания воздуха — фурмы.
На рис. 14.1. представлена схема доменного процесса. Загрузка домны шихтой производится через колошник слоями: слой руды, слой кокса, слой флюсов. Три таких слоя (руда, кокс, (флюс) носят название калоши. Снизу через фурмы в домну все время вдувается предварительно нагретый воздух (600-800 °C). При продувании воздуха через разогретую массу в доменной печи происходят следующие химические процессы, кислород воздуха реагирует с углеродом, образуя углекислый газ. Этот процесс сопровождается выделением большого количества теплоты, поэтому в области фурм темпера тура достигает 1800-1900 °С. Углекислый газ реагирует с раскаленным коксом с образованием монооксида углерода, который восстанавливает железо из его оксидов до свободного металла.
Доменная печь работает непрерывно в течение 10 лет, после чего останавливается на капитальный ремонт.
Одновременно с восстановлением железа из оксидов происходит взаимодействие железа с углеродом: образуется карбид железа Fe3C, который растворяется в чугуне. Часть углерода попадает в чугун в виде графита. Если в чугуне большая часть углерода находится в виде карбида, такой чугун называется белым. Он более твердый, хрупкий и не поддается механической обработке. Если же большая часть углерода находится в виде графита, то такой чугун называется серым. Он более мягок, менее хрупок и легче поддается механической обработке.
Расплавленный чугун как более тяжелый находится в нижнем слое, а все оксиды, которые не растворяются в расплавленном чугуне и хорошо растворяются в расплавленном силикате кальция, в виде шлака находятся в верхнем слое Чугун и шлак периодически выпускаются из печи через специальные желоба.
Если в печь подавать воздух, обогащенный кислородом, ее производительность значительно повышается.
В зависимости от содержания кремния, марганца, фосфора, серы и углерода различают три вида чугунов литейные, используемые для отливки чугунных изделий передельные, перерабатываемые в сталь, и специальные, из которых изготовляют конструкционные материалы для машиностроительной и приборостроительной промышленности.
Производство стали. В процессе переработки чугуна в сталь из чугуна удаляется избыток углерода, серы, фосфора, кремния, марганца и других элементов. Эти примеси переводят в оксиды, которые либо улетучиваются (СО и CO2), либо переходят в шлак. Переработка чугунов в сталь осуществляется тремя способами кислородно-конвертерным, мартеновским и электрометаллургическим.
При переработке чугунов кислородно-конвертерным способом в конвертер (рис. 14.2) заливают жидкий чугун и через верхнюю трубу 7 называемую фурмой, продувают технический кислород под давлением 4-5 атм. Расплавленный чугун перемешивается, основная масса примесей окисляется. Летучие оксиды (СО, СО2 и SO2) уносятся газовым потоком, а оксиды металлов и фосфора переходят в шлак. Если в чугуне много фосфора, то шлак делают основным, т. е. с большим содержанием оксида кальция:
Р2O5 + 3 CaO = Са3(РO4)2
Если в чугуне много марганца и других металлов, то шлак делают кислотным, т. е. содержащим избыток кремнезема:
MnO + SiO2 = MnSiO3
Конвертерный способ отличается высокой производительностью, но этим способом можно получить только сравнительно низкосортную сталь, так как кратковременность процесса не позволяет регулировать состав стали во время плавки

Рис 14.2. Конвертер для выплавки стали.
В мартеновском способе используют твердые окислители — оксиды железа содержащиеся в руде, окалине и скрапе (металлоломе). Мартеновский процесс проводят в специальных печах, которые называются мартеновскими. Мартеновские печи относятся к типу пламенных — они нагреваются пламенем, получаемым при сжигании горючих газов над поверхностью нагреваемой массы. В печь загружают чугун, руду и скрап в таком соотношении, чтобы кислорода оксидов железа было достаточно для окисления определенного количества примесей. Флюсы подбирают так, чтобы шлак был кислым или основным — в зависимости от характера выводимых примесей. Процесс плавки длится 5-6 ч. В течение этого времени периодически берут пробы расплавленной стали, определяют ее состав и вносят необходимые компоненты в виде ферросплавов (сплавов железа с различными металлами и неметаллами, такими, как никель, марганец, титан, молибден, вольфрам, хром, кремний и др.). Большая длительность плавки позволяет изготовить сталь заданного состава. Применение воздуха, обогащенного кислородом, дает возможность достичь более высокой температуры, что позволяет интенсифицировать процесс плавки и сократить ее время до 4 ч.
Специальные стали варят в электрометаллургических печах, отличающихся от пламенных тем, что источником тепла в них является электрический ток. В электрометаллургических печах можно достичь более высокой температуры, поэтому в них варят тугоплавкие стали.
Все стали классифицируются по химическому составу и назначению. По химическому составу стали делятся на углеродистые и специальные (содержащие кроме углерода, серы, фосфора, марганца и кремния, имеющихся и в углеродистых сталях, легирующие элементы — никель, хром, ванадий, вольфрам, молибден). Они улучшают свойства стали. Так, хром повышает ее твердость, прочность в устойчивость к действию кислот, никель — механическую прочность и вязкость, вольфрам — твердость, ванадий — вязкость и упругость. титан — термостойкость, молибден улучшает механические свойства.
По назначению стали делятся на инструментальные, строительные, или конструкционные, применяемые для изготовления машин и аппаратов, и стали специального назначения.
По наличию шлаковых включений и вредных примесей они делятся на высококачественные, качественные и торговые.
Качество стальных изделий можно улучшить термической обработкой, цементацией, азотированием, алитированием и нанесением других антикоррозионных покрытий.
При термической обработке стали используют ее свойство изменять структуру с изменением температуры. Если нагретую сталь охлаждать постепенно, то ее кристаллическая структура резко меняется. При структуре, характерной для низкой температуры, сталь отличается низкой твердостью и прочностью. Если же нагретую до высокой температуры сталь охладить резко, то сохранится структура, характерная для высокой температуры. Этот процесс называется термической закалкой. Сталь, подвергнутая такой обработке, очень твердая и прочная. Для каждого сорта стали существуют свои условия термической закалки: скорость нагревания, степень нагрева, скорость охлаждения. Если сталь, прошедшую термическую закалку, снова нагреть до высокой температуры и медленно охладить, то она теряет приобретенные вследствие закалки механические свойства, становится мягкой. Такой процесс называется отпуском стали.
Цементация — процесс получения на поверхности изделия карбида железа, отличающегося высокой твердостью. Такое изделие имеет в середине мягкое железо, а на поверхности — очень твердый карбид. Процесс цементации осуществляют длительным нагреванием изделия в атмосфере монооксида углерода или в ящиках, наполненных древесными опилками.
Азотирование — процесс, аналогичный цементации: изделие подвергают длительному нагреванию в атмосфере аммиака.
Алитирование — процесс покрытия поверхности изделия алюминием.
Глава 7.15. МЕТАЛЛЫ
§ 7.1. Общие свойства металлов
Все элементы периодической системы элементов условно делят на две группы: металлы и неметаллы. К металлам относятся преимущественно элементы, на внешнем электронном слое которых имеется один, два или три валентных электрона:
1) все s-элементы, за исключением водорода и гелия;
2) все d- и f-элементы (на внешнем энергетическом уровне они имеют два или один валентный электрон);
3) р-элементы III группы, за исключением бора;
4) некоторые р-элементы IV и V групп, расположенные в VI и VII периодах: олово, свинец, сурьма и висмут (на внешнем уровне они имеют соответственно четыре и пять валентных электронов).
Деление на металлы и неметаллы весьма условно. Так, например, металл германий обладает многими неметаллическими свойствами.
Хром и алюминий — типичные металлы, но образуют соединения, в которых проявляют неметаллические свойства: КАlO2, КСrО2, K2CrO4, К2Сr2О7. Теллур и иод — типичные неметаллы, но обладают некоторыми свойствами, присущими металлам.
Если в таблице привести диагональ через бор и астат, то в главных подгруппах справа от диагонали окажутся неметаллы, а в главных подгруппах слева от диагонали, в побочных подгруппах и VIII группе (исключая инертные газы),— металлы. Из 107 известных в настоящее время элементов 86 являются металлами.
Физические свойства. Все металлы, за исключением ртути, при обычных условиях — твердые вещества. В компактном состоянии они обладают характерным блеском, а в измельченном (порошкообразном) состоянии все металлы, за исключением магния и алюминия, имеют черный или темно-серый цвет.
Металлы делятся на легкие (r < 5 г/см3 ) и тяжелые (r > 5 г/см3 ). К легким металлам относятся литий, натрий, калий, магний, алюминий, а к тяжелым — цинк, медь, железо, олово, свинец, серебро, золото. Самый легкий металл — литий — имеет r = 0,534 г/см3, а самый тяжелый — осмий — 22,5 г/см3.
Металлы обладают хорошей ковкостью, электро- и теплопроводностью. Самым ковким и пластичным металлом является золото, из него можно изготовлять листы толщиной 0,003 мм.
Наибольшей электропроводностью обладает серебро, затем идут медь, золото, алюминий.
В узлах кристаллических решеток металлов находятся положительно заряженные ионы, а между ними свободно перемещаются электроны — так называемый электронный газ. Свободным перемещением электронов объясняется высокая электро- и теплопроводность металлов.
Металлы значительно различаются по твердости. Самые мягкие — натрий, калий и индий — можно резать ножом, самый твердый — хром — режет стекло.
Металлы делятся на легкоплавкие и тугоплавкие. Температура плавления легкоплавких металлов равна: цезия 28,5 °С, галлия 29,1, калия 62,3, натрия 97,8, олова 231,85, свинца 327,4 °С.
Температура плавления тугоплавких металлов равна: железа 1539 °С, платины 1773,5, хрома 1903 °С. Наиболее тугоплавкий металл-вольфрам — плавится при 3370 °С.
Металлы делятся на черные (железо, марганец, хром) и цветные (все остальные). Цветные металлы, в свою очередь, по разным признакам делятся на подгруппы: тяжелые (например, медь цинк, свинец, ртуть), легкие (например, калий, натрий, магний, алюминий), редкие (например, литий, рубидий, цезий, бериллий, молибден, вольфрам, цирконий, гафний, ванадий, ниобий, тантал), редкоземельные (скандий, иттрий, лантан и лантаноиды), рассеянные (галлий, индий, таллий, германий, рений), благородные (золото, серебро, платина, палладий, родий, иридий, рутений и осмий) и радиоактивные (радий, торий, уран, актиний и актиноиды).
Химические свойства. Атомы металлов только отдают электроны, образуя положительно заряженные ионы. Поэтому они всегда выступают как восстановители.
Атомы металлов отдают электроны атомам неметаллов и ионам других, менее активных, металлов. Реакции металлов с неметаллами протекают с различными скоростями и при различных температурах. Так, щелочные металлы очень легко окисляются кислородом воздуха, тогда как железо или медь энергично окисляется только при нагревании, золото и платиновые металлы вообще не окисляются кислородом. Поверхность многих металлов покрывается пленкой оксидов, которая предохраняет их от дальнейшего окисления.
Способность металла отдавать электроны определяет его активность, чем легче металл отдает электроны, тем он активнее и тем более энергично вступает в химические реакции. По признаку активности все металлы можно расположить в ряд, который называют рядом активности или рядом напряжений. Активность металлов впервые изучил профессор Харьковского университета Н. Н. Бекетов, поэтому ряд напряжений называют также рядом Бекетова. Ряд напряжений имеет приблизительно такой вид (в ряду приведены не все металлы):
... К... Ca... Na... Mg... Al... Zn... Fe... Ni... Sn... Pb... H.... Cu... Hg... Ag... Au...
В ряд напряжений помещен также водород, который, как и металлы, отдает электрон, образуя положительно заряженный ион.
На основании ряда напряжений можно сделать три основных заключения о химической активности металлов:
1) каждый металл вытесняет из солей другие металлы, находящиеся в ряду напряжений правее него, и сам может быть вытеснен металлами, расположенными левее;
2) все металлы, стоящие в ряду левее водорода, вытесняют его из кислот (могут растворяться в кислотах с выделением водорода), а стоящие правее — не вытесняют (в кислотах-неокислителях не растворяются);
3) чем левее в ряду напряжений находится металл, тем он активнее, тем более сильным восстановителем он выступает и тем труднее восстанавливаются его ионы.
При погружении цинковой пластинки в раствор соли меди (цинк стоит в ряду левее меди) цинк окисляется и переходит в раствор, а катионы меди восстанавливаются до свободной меди, которая выделяется на цинковой пластинке. В данном случае атомы цинка — восстановители, а ионы меди — окислители:
Zn + Сu2+ = Zn2+ + Cu
Получение металлов. Металлы встречаются в природе в виде оксидов, сульфидов, сульфатов, карбонатов, хлоридов, фосфатов и нитратов. В свободном (самородном) состоянии встречаются только золото, платина и (значительно реже) ртуть, олово а некоторые другие малоактивные металлы. Производство, занимающееся получением металлов, называется металлургическим.
Минералы, содержащие элементы и их соединения я пригодные для получения металлов или неметаллов и их соединений, называются рудами. Содержание некоторых металлов в рудах очень невелико, поэтому эти руды обогащают и получают концентраты, являющиеся сырьем для производства металлов.
Наиболее пригодны для получения металлов их оксиды. Поэтому сульфиды сначала переводят в оксиды путем обжига их в специальных печах. Полученные оксиды восстанавливают при высокой температуре различиями восстановителями, такими, как уголь, кокс, водород или некоторые активные металлы (металлотермия). Этот метод называется пирометаллургическим. Иногда оксид растворяют в кислоте и получают электролит, из которого металл выделяют путем электролиза. Этот метод переработки руды называется гидрометаллургическим.
Металлы, которые хорошо взаимодействуют с водой, расположены слева от водорода в ряду активности, получают электролизом их расплавленных солей.
Применение металлов. В чистом виде металлы применяются редко, значительно чаще используются их сплавы.
Чугун — сплав на основе железа, содержащий более 2% углерода, а также марганец, кремнии, фосфор и другие элементы. Чугун значительно тверже железа. Применяется для изготовления массивных деталей различных машин и служит сырьем для получения сталей.
Сталь — сплав на основе железа, содержащий менее 2% углерода, хром, марганец, кремний, никель и так называемые легирующие добавки, придающие стали твердость, жаростойкость, химическую устойчивость и другие ценные качества. Сталь является основным материалом в машиностроении и многих других отраслях народного хозяйства.
Латунь — сплав на основе меди, содержащий от 10 до 50% цинка. Латунь широко применяется в моторостроении. Бронза — сплав на основе меди с добавкой (до 20%) олова. Бронза хорошо отливается. Ее используют в машиностроении (подшипники, поршневые кольца, клапаны, различная арматура) и для художественного литья.
Константан — сплав, содержащий около 60% меди, 39-40% никеля и 1-2% марганца.
Мельхиор содержит около 80% меди и около 20% никеля. Нихром — сплав на основе никеля (60%), содержащий 14-18% железа и около 18% хрома. Обладает высоким электрическим сопротивлением, применяется для изготовления нагревательных приборов. Хромель содержит около 90% никеля и около 10% хрома. Алюмель — сплав 95% никеля, 1,8-2,5% алюминия, 1,8-2,2% марганца и 0,85-1,15% кремния. Хромель и алюмель широко применяются для изготовления термоизмерительной аппаратуры.
Баббиты — сплавы, содержащие около 65% свинца, 15-17 % олова, 15-17% сурьмы и около 2% меди. Применяются для изготовления подшипников.
Дюралюминий — сплав на алюминиевой основе, содержащий 3-5% меди, около 1% магния и столько же никеля и марганца, Имеет хорошие механические свойства и применяется в самолето- и машиностроении.
Силумин содержит 86-88% алюминия и 12-14% кремния. Имеет хорошие механические свойства, применяется для изготовления различных деталей. Изделия из него не теряют прочности при температуре до 300 °С.
Для измерительной и сигнальной аппаратуры применяют легкоплавкие сплавы. Сплав, содержащий 36% висмута, 28% свинца, 6% кадмия и 30% ртути, плавится уже при 48 °С.
 2020-10-11
2020-10-11 408
408







