В уравнениях полуреакцийокисления и восстановления, исходные вещества и продукты реакции записываем в молекулярной или ионной формах
3С2Н4+2KMnO4+4Н2О= 3С 2Н 4(ОН) 2+ 2MnO 2+ 2KOH
С2Н 4 + 2O-2 + 2Н + - 2ē → С2Н 4(ОН) 2 \3
MnO4- + 3ē+4Н+→ MnO2+2Н2О\2
УРАВНЕНИЕ НЕРНСТА
Для ОВР применяют потенциометрические методы исследования,которые основаны на измерении электродвижущей силы (ЭДС):
E=E1-E2, где E-электродвижущаясила(ЭДС);
E1 и E2 - потенциалы электродов исследуемой цепи.
Потенциал электрода E связан с активностью и концентрацией веществ, участвующих в электродном процессе, уравнением Нернста:
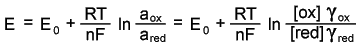 | (1) |
,где E0-стандартный потенциал редокс-системы;
R - универсальная газовая постоянная, равная 8,312 Дж/(моль К);
T-абсолютная температура
F -постоянная Фарадея, равная 96485 Кл/моль;
n - число электронов, принимающих участие в электродной реакции;
aox, ared - активности соответственно окисленной и восстановленной форм редокс-системы; [ox] и [red] - их молярные концентрации;
γox, γred - коэффициенты активности.
E =E0 при aox = ared = 1, причем имеется в виду гипотетический стандартный 1 М раствор, в котором коэффициент активности каждого растворенного вещества равен 1, а чистые вещества находятся в наиболее устойчивом физическом состоянии при данной температуре и нормальном атмосферном давлении.
Подставляя T=298,15 и числовые значения констант в уравнение, получаем для 25 °C
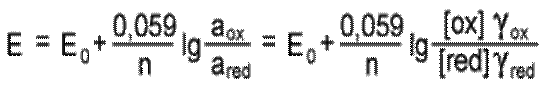 | (2) |
Однако потенциал отдельного электрода экспериментально определить невозможно. Относительные значения электродного потенциала находят, комбинируя данный электрод со стандартным водородным электродом, который является общепринятым международным стандартом. Потенциал водородного электрода принят равным нулю при всех температурах, поэтому потенциал данного электрода - это, в сущности, ЭДС элемента, состоящего из данного и стандартного водородного электрода.
Конструктивно стандартный водородный электрод представляет собой платинированную платиновую пластинку, омываемую газообразным водородом при давлении 1,013.105 Па (1 атм) и погруженную в раствор кислоты с активностью ионов H+, равной единице. При работе водородного электрода протекает реакция
H2(г) = 2H+ + 2e-
В практической работе вместо хрупкого и нередко капризного водородного электрода применяют специальные, более удобные в работе стабильные электроды сравнения, потенциал которых по отношению к стандартному водородному электроду точно известен.
Уравнение (2) можно переписать
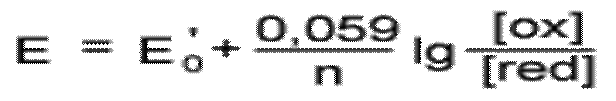 | ( |
или
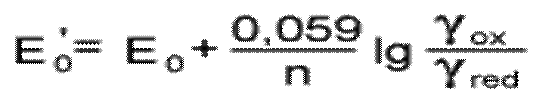
Величину E0' называют формальным потенциалом. Как видно, формальный потенциал характеризует систему, в которой концентрации (а не активности) всех участников равны 1,0 моль/л. Формальный потенциал включает в себя коэффициенты активности, т.е. зависит от ионной силы раствора. Если коэффициент активности равен 1, то E0'=E0, т.е. формальный потенциал совпадает со стандартным потенциалом. Точность такого приближения для многих расчетов оказывается достаточной.
Природа возникновения потенциала различна. Можно выделить следующие три основные классы потенциалов, которые не исчерпывают, конечно, всего многообразия. Это-
2. Редокс-потенциалы.
3. Мембранные потенциалы.
Хотя потермином "электродный потенциал" нередко имеют в виду любой потенциал, независимо от механизма его возникновения, в более узком понимании - это потенциал непосредственно связанный с материалом электрода. Например, цинковый электрод:
Zn2+ + 2e- = Zn
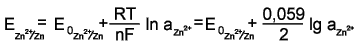
 2020-10-12
2020-10-12 741
741








