Коррозией называется разрушение металлов вследствие химического воздействия внешней среды; при этом металл окисляется и теряет присущие ему свойства. Коррозия приводит к большим материальным потерям, происходящим в результате нарушения целостности трубопроводов, цистерн, металлических частей машин, корпусов судов, морских сооружений и т.п. Безвозвратные потери металлов от коррозии составляют 8 - 10 % от ежегодного их выпуска.
По механизму протекания коррозия подразделяется на два типа:
1) химическую, которая наблюдается при взаимодействии металлов с сухими газами и жидкостями, не проводящими ток (неэлектролитами);
2) электрохимическую, которая наблюдается при взаимодействии металлов с растворами электролитов. К электролитам относится вода обычная и морская, растворы солей, кислот и щелочей, влажные газы. Во влажных газах и в воздухе содержатся пары воды, которые адсорбируются на поверхности металлов, образуя тонкую невидимую пленку жидкой воды, в которой растворяются кислород, СО2, SO2, NO2 и другие газы, присутствующие в атмосфере; таким образом, во влажном воздухе на металл действует раствор электролита.
Электрохимическая коррозия является следствием возникновения коррозионных гальванических микроэлементов (коррозионных гальванических пар), состоящих из катодных и анодных участков. Появление катодных и анодных участков на поверхности металла происходит по следующим причинам:
Ø неоднородность поверхности металла вследствие включений иной природы, ударов и изгибов, накопления примесей на границах зерен, участков с разной степенью термической и механической обработки и т.п.;
Ø неоднородность жидкой фазы, в которой происходит коррозия, из-за различия концентрации ионов, рН среды, неравномерного доступа кислорода или других окислителей;
Ø различие внешних условий: температуры, давления, действие электрического поля и т.п.
При возникновении коррозионной гальванической пары процесс электрохимической коррозии можно представить как состоящий из четырёх стадий:
1) Окисление части металла, которая имеет меньшее значение электродного потенциала; эта часть в коррозионной гальванической паре является анодом.
2) Перенос заряда электронами по металлу от анодного к катодному участку.
3) Перенос заряда ионами в электролите.
4) Восстановление окислителя на катодном участке поверхности металла.
При электрохимической коррозии наиболее распространенными окислителями являются растворенный в воде и щелочных растворах кислород, восстанавливающийся по схеме:
О2 + 4е- + 2Н2О = 4ОН-,
и катионы водорода в кислых растворах (кислород в кислой среде не растворяется), восстанавливающиеся по схеме:
2Н+ + 2е- = Н2.
Ржавчина - продукт взаимодействия внешней окислительной атмосферы с железом. Процесс ее образования называется ржавлением (коррозия). Термин «ржавчина» присущ только продуктам коррозии железа и его сплавов. Любые другие металлы могут корродировать, но не ржаветь!
Ржавление железа — это электрохимический процесс, который начинается с переноса электронов от железа к кислороду. Скорость коррозии зависит от количества имеющейся воды, и ускоряется электролитами, о чём свидетельствуют последствия применения дорожной соли на коррозию автомобилей.
Ключевой реакцией является восстановления кислорода:
O2 + 4ē + 2H2O → 4OH-
Поскольку при этом образуются гидроксид-ионы, этот процесс сильно зависит от присутствия кислоты. Действительно, коррозия большинства металлов кислородом ускоряется при понижении pH. Обеспечение электронов для вышеприведённой реакции происходит при окисления железа, которое может быть описано следующим образом:
Fe0 - 2ē → Fe2+
Это начальная стадия коррозии. На второй стадии катионы железа и гидроксид-ионы соединяются, образуя ржавчину:
Fe2+ + 2OH- → Fe(OH)2
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Упрощённо этот процесс можно выразить следующим уравнением химической реакции:
4Fe + 3O2 + 6Н2O = 4Fe(OH)3
Коррозия металла ускоряется или замедляется при его контакте с другими металлами. Ускорение коррозии происходит при контакте металла с менее активным металлом, расположенном в ряду электрохимической активности правее, так как в этом случае данный металл в коррозионной гальванической паре становится анодом. При контакте металла с более активным металлом коррозия основного металла наоборот замедляется, так как в коррозионной гальванической паре этот металл является катодом. Именно по этой причине кровельное железо покрывают более активным металлом цинком, а не оловом или медью.
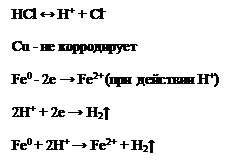

В контакте с Cu коррозия Fe усиливается, т.к. Cu является элементом менее активным, чем Fe. Медь подвергаться коррозии не будет, но усиливает коррозию железа. Коррозия металла тем выше, чем дальше в ряду напряжения стоят металлы друг от друга. Для защиты Fe от коррозии таким образом следует брать металлы более активные, чем железо (Al или Zn). Если электролитом являются кислоты, то на катоде будет выделяться Н2 или О2.
Защита от коррозии.
Ввиду больших экономических потерь, происходящих в результате коррозии, применяются разнообразные методы предупреждения коррозии и защиты от нее. Важнейшими являются следующие методы.
Легирование металлов. Легированием металлов называется процесс введения в их состав других металлов, т.е. получение сталей и сплавов, обладающих высокой устойчивостью против коррозии. Наиболее распространено легирование хромом, никелем и титаном.
Металлические покрытия. Для покрытия малостойких против коррозии металлов применяют металлы, образующие на своей поверхности защитные пленки. К таким металлам относятся хром, никель, алюминий, цинк, кадмий, олово и др. Покрытия наносят распылением расплавленного металла, электролизом, химическим осаждением и другими методами.
Неметаллические покрытия. Неметаллические покрытия подразделяются на неорганические и органические. Распространенными неорганическими покрытиями являются оксидные, фосфатные и нитридные пленки на поверхности металлов, а органические – лаки, краски, пленки полимеров и резины.
Электрохимическая защита. Она применяется в тех случаях, когда защищаемая конструкция находится в среде электролита: корпус морского судна, трубопровод на дне реки и т.д. Защищаемая конструкция присоединяется к отрицательному полюсу внешнего источника постоянного тока, и он становится катодом. В качестве анодов используются куски железа. На защищаемом изделии повышается поверхностная концентрация электронов, на поверхности происходит восстановление окислителя, а процесс окисления (коррозия) идет на аноде.
Применение ингибиторов коррозии. Ингибиторами называются вещества, добавление которых в коррозионную среду в незначительных количествах заметно снижает скорость коррозии. Ингибиторами являются различные неорганические соединения (нитрит натрия, хромат и дихромат калия, фосфат и гидрофосфаты натрия) и многие органические вещества. Защитное действие ингибиторов обусловлено тем, что их молекулы или ионы адсорбируются на поверхности металлов, замедляя или прекращая процесс анодного окисления.
Порядок выполнения работы:
1. Ознакомьтесь с теоретическими основами.
2. Ответьте на контрольные вопросы.
Требования к отчету:
Отчет должен содержать:
Ø Номер работы
Ø Название работы
Ø Цель работы
Ø Ответы на контрольные вопросы с необходимыми уравнениями реакций
Ø Вывод
Контрольные вопросы:
1. Объясните, что означает термин "коррозия металла".
2. Чем отличается химическая коррозия от электрохимической?
3.Как объяснить сущность коррозии - ржавление железа? При каких условиях она происходит? Запишите уравнения реакций.
4. Какой из металлов под действием коррозии в среде электролита HCl будет разрушаться: медь, покрытая оловом? Поясните эти процессы, подтвердите ответ записью соответствующих уравнений.
5. Каким металлом: Cu, Zn или Hg - можно покрыть изделие из железа с целью защиты его от коррозии? Почему?
6. Что такое ингибиторы коррозии? Что такое протекторы? Чем отличается механизм их действия при защите металлов от коррозии?
7. Объясните процессы, изображенные на рисунке:

Рис. Влияние факторов окружающей среды на коррозию металлов.
 2020-10-12
2020-10-12 131
131






