С, Si 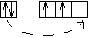 степень окисления 2,4
степень окисления 2,4
R атома à
Восстановительные свойства ß
Нахождение в природе:
Углерод: уголь, нефть, газ, атмосфера (CO2 0,03%), известняк, мрамор мел (CaCO3), MgCO3-магнезит, CaCO3ּMgCO3 — доломит
Кремний: (2е место после кислорода по распространению, его значение в минеральном мире как у углерода в органическом) SiO2, горный хрусталь, силикаты в горных породах (асбест, каолин, глины).
Получение: С- добыча полезных ископаемых;
Si - SiO2+C+Fe→(эл. печь)ферросилиций (25% Fe), технический Si (2-5 % Fe)
SiO2+Znпар→t ZnO4+Si
SiO2+Mg→t MgO+Si
Использование:
С – присуща аллотропия: графит,алмаз,карбид, фуллерен (60С, 70С),инертен,активность проявляет при ↑Т
С+(S, Cl2, Me, O2)→t (+) C+O2→t CO2; C+O2 нед→CO+CO2
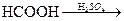 СО+Н2О
СО+Н2О
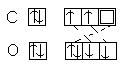
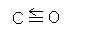
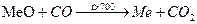 ; CO2: O=C=O (неполярная молекула)
; CO2: O=C=O (неполярная молекула)
Получение:
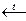 CaCO3
CaCO3 § Растворение в Н2О: CO2+H2O→←H2CO3
| (Ca(OH)2+CO2→CaCO3↓+H2O CaCO3↓+H2O+CO2→Ca(HCO3)2) | à лежит в основе разрушения горных пород и строит. камней |
CaO+H2O=Ca(OH)2
Na2CO3 – сода, (моющие ср-ва)
(CuOH)2CO3- малахит
Si- аморфный (химически более активная форма), кристаллический.
Si- полупроводник, под влиянием тепла валентные электроны могут стать электронами проводимости, обуславливая n-проводимость (negative) электронная, освободившиеся от электронов места обуславливают p-проводимость (positive). У химически чистого кремния n- и p-проводимость равны, однако пользуясь различными добавками можно изменять их соотношение: (Si(4e)+B(3e))—дефицит электронов, ↑p-проводимость; (Si(4e)+P(5e))— дефицит дырок, ↑n-проводимость.
При высоких t Si является очень сильным восстановителем, его применяют металлурги для удаления из расплавов Ме растворённого в нём О2. Кремний стоек ко всем кислотам, кроме плавиковой, не устойчив к водным растворам щёлочи.
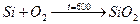
Si +4HF=SiF4+2H2↑
Si+2NaOH+H2O=Na2SiO3+2H2↑
O2: SiO, SiO2(наиболее распространён в природе); SiO2+Si=2SiO.
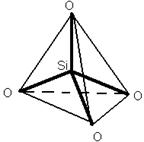 в результате объединения тетраэдров образуются замкнутые кольца. Для разрушения SiO2 надо разрушить очень много прочных связей Si-O. В зависимости от пространственного расположения тетраэдров SiO4 существуют различные полиморфные состояния SiO2: кварц→← тридимит →← кристоболит(химическая активность ↑ от кварца к кристоболиту)
в результате объединения тетраэдров образуются замкнутые кольца. Для разрушения SiO2 надо разрушить очень много прочных связей Si-O. В зависимости от пространственного расположения тетраэдров SiO4 существуют различные полиморфные состояния SiO2: кварц→← тридимит →← кристоболит(химическая активность ↑ от кварца к кристоболиту)
SiO2+HF→SiF4+H2O
SiO2+NaOH→Na2SiO3+H2O
SiO2+Na2CO4→ Na2SiO3+CO2
Растворимы в воде.
(Na2SiO3+K2 SiO3)-канцелярский клей, применяют строители для укрепления слабых грунтов и для изготовления кислородного цемента.
| Na2SiO3+H2O→← Na2SiO5+NaOH 2 SiO32-+H2O→← SiO52-+2OH- | pH>7 |
Na2SiO3+2HCl= Na2SiO5↓(очень слабая желеобразная кислота)+ 2NaCl
В зависимости от условий получения можно получить:
H2SiO3 (SiO2∙H2O)-метакремниевая кислота
H2SiO4 (SiO2∙2H2O)-ортокремневая кислота
H2Si2O5 (2SiO2∙H2O)-диметокремневая кислота
Кремниевые кислоты поляризуются, их состав неизвестен. (x SiO2∙yH2O)
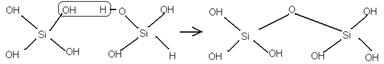 H6Si2O7
H6Si2O7
C учётом поляризации:
Na2SiO3+H2SO4+H2O→x SiO2∙yH2O+ Na2SO4
Если полученный гель кислоты промыть водой от Na2SO4 и высушить, то получатся прозрачные пластинки силикагеля. Это прекрасный поглотитель влаги, обладает ионно обменными свойствами, применяют как носитель катализатора.
Взаимодействия SiO2+CaO (песок и известью). Эти процессы лежат в основе получения и применения цемента
CaSiO3 (SiO2∙H2O)-метасиликат кальция
Ca2SiO4 (SiO2∙2H2O)-ортосиликат кальция
Ca3SiO5 (2SiO2∙H2O)-3х кальциевый силикат
Ca3Si2O7 (SiO2∙H2O)- 3х кальциевый дисиликат
При наличии H2O происходит гидролиз или гидратация.
CaSiO3 +(n+1) H2O →Ca(OH)2+ SiO2 ∙n H2O гель
Ca2SiO4+m H2O = CaSiO4∙ m H2O
В результате гидролиза получаются зёрна малорастворимого Ca(OH)2, вокруг которых накапливается студенистый гидросиликат и кремниевые кислоты, полученная пастообразная масса затвердевает, схватывается, благодаря наличию молекул H2O, которые склеивают полученные гидросиликаты.
Силикаты, содержащие Al, называются алюмосиликаты, в них Al заменяет часть кремния в тетраэдрах SiO4.
Алюмосиликаты K+, Na+, Ca+ называют полевыми шпатами (50% земной массы): глины, граниты, слюда.
Некоторые алюмосиликаты обладают ионно обменными свойствами.
Стекло: SiO2+Na2CO3+CaCO3 Na2O∙CaO∙6SiO2+CO2
Na2O∙CaO∙6SiO2+CO2
SiO2 – кварцевое стекло, коэффициент линейного расширения = 0, раскалённое до красна на трескается в холодной воде, пропускают кварц, если добавить В2О3 или Na2B4O7-оптическое стекло.
Применение:
· Стекловата, теплоизоляционный материал
· Стекло аморфно, но в результате некоторых добавок может закристаллизоваться, получают ситалл, применяют в качестве изоляторов в химической промышленности
· Глины: трудно растворимые осадочные породы, получаются в результате разрушения горных пород, содержат силикаты и алюмосиликаты, применяют в производстве цемента, керамики, фарфора. Керамика – изделия из глины с добавкой оксидов и карбидов некоторых металлов для прочности. Эмаль – тонкое стеклянное покрытие, предохраняет керамику от коррозии и придаёт декоративный вид.
· Цемент – получают спеканием глины с известняком (глина + известняк) (глина + CaO)+CO2↑
(глина + CaO)+CO2↑
(цемент + H2O)→цементный раствор
цементный раствор+щебень (гравий)→бетон–чрезвычайно прочная конструкция.(бетон + Fe→железобетон)
фторосиликаты: SiO2+4HF=SiF4+2H2O
SiF4+4HF=H2[SiF6] – кремнистофтороводородная кислота, НF – слабая кислота.
Mg2+,Ca2+,Fe3+,Zn2+хорошо растворимы в воде, большое практическое применение в процессе флюатирования
Mg[SiFe]+2CaCO3+nH2O→MgF2↓+CaF2↓+SiO2∙nH2O (гель)+2СО2↑
Таким образом предохраняют камни
SiO2+C (кокс)  SiC (карборунд – по структуре алмаз, половина атомов С заменена на кремний.)
SiC (карборунд – по структуре алмаз, половина атомов С заменена на кремний.)
 2014-02-04
2014-02-04 1341
1341
