1. Растворы кислот изменяют окраску индикаторов: лакмуса – на красную, метилового оранжевого – на розовую; фенолфталеин в растворах кислот остается бесцветным.
2. Кислоты в растворах взаимодействуют с металлами, находящимися в ряду стандартных электродных потенциалов (ряду напряжений) до водорода:
Zn + 2HCl ® ZnCl2(р-р) + Н2; Zn + 2H+ ® Zn2+ + H2
Исключение: HNO3 и H2SO4 (конц.) окисляют металлы не за счет Н+, а за счет NO3– и SO42– (см. ниже).
3. Кислоты в растворах взаимодействуют с основными оксидами
H2SO4 + MgO ® MgSO4 + H2O; 2H+ + MgO ® Mg2+ + H2O
2HCl + CuO ® CuCl2 + H2O; 2H+ + CuO ® Cu2+ + H2O
4. Взаимодействие кислот с основаниями (реакция нейтрализации)
HCl + KOH ® KCl + H2O; H+ + OH– ® H2O
H2SO4 + Cu(OH)2 ® CuSO4 + 2H2O; 2H+ + Cu(OH)2 ® Cu2+ + 2H2O
5. Взаимодействие с амфотерными оксидами и гидроксидами:
H2SO4 + ZnO ® ZnSO4 + H2O; 2H+ + ZnO ® Zn2+ + H2O
2HCl + Zn(OH)2 ® ZnCl2 + 2H2O; 2H+ + Zn(OH)2 ® Zn2+ + 2H2O
6. Взаимодействие с солями:
Na2SiO3 + H2SO4 ® Na2SO4 + H2SiO3¯; SiO32–(р-р) + 2H+ (р-р) ® H2SiO3.
H2SO4(р-р) + BaCl2(р-р) ® BaSO4(т) + 2HCl(р-р); SO42–(р-р) + Ba2+(р-р) ® BaSO4(т).
Таким образом, общие характерные свойства кислот обусловлены ионами водорода.
4. Амфотерные гидроксиды. В свете теории электролитической диссоциации амфотерными гидроксидами называются электролиты, при диссоциации которых образуются одновременно и ионы водорода, и гидроксид-ионы:
2ОН– + Zn2+ + 2H2O ⇄ Zn(OH)2 + 2H2O ⇄ [Zn(OH)4]2– + 2H+;
3ОН– + Al3+ + 3H2O ⇄ Al(OH)3 + 3H2O ⇄[Al(OH)6]3– + 3H+.
Амфотерные гидроксиды взаимодействуют как с растворами кислот, так и с растворами щелочей:
– с кислотами
Al(OH)3(т) + 3НСl(р-р) ® AlCl3(р-р) + 3Н2О(ж); Al(OH)3(т) + 3Н+(р-р) ® Al3+(р-р) + 3Н2О(ж);
Zn(OH)2(т) + H2SO4(р-р) ® ZnSO4(р-р) + 2Н2О(ж); Zn(OH)2(т) + 2Н+(р-р) ® Zn2+(р-р) + 2Н2О(ж);
– со щелочами
Al(OH)3(т) + 3NaOH(р-р) ® Na3[Al(OH)6](р-р); Al(OH)3(т) + 3ОH–(р-р) ® [Al(OH)6]3–(р-р)
гексагидроксоалюминат-ион
Zn(OH)2(т) + 2NaOH(р-р) ® Na2[Zn(OH)4](р-р); Zn(OH)2(т) + 2ОH–(р-р) ® [Zn(OH)4]2–(р-р)
тетрагидроксоцинкат-ион
В расплавах (в безводной среде) комплексообразования не происходит:
Al(OH)3 + NaOH 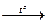 NaAlO2 + 2H2O Zn(OH)2 + 2KOH
NaAlO2 + 2H2O Zn(OH)2 + 2KOH 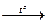 K2ZnO2 + 2H2O
K2ZnO2 + 2H2O
5. Соли. В свете теории электролитической диссоциации солями называются электролиты, при диссоциации которых образуются катионы металлов (или аммония) и анионы кислотных остатков: Na3PO4 ⇄ 3Na+ + PO43–; (NH4)2SO4 ⇄ 2NH4+ + SO42–.
 2014-02-05
2014-02-05 2445
2445
