Геохимическая классификация химических элементов
В настоящее время в геохимии предложен ряд классификаций химических элементов, которые отражают их распределение и поведение в природных биосферных процессах и связаны с химическими свойствами элементов.
Наиболее общепринятыми в настоящее время считаются классификации В.И.Вернадского (таблица 1.7) и В.М.Гольдшмидта (таблица 1.8).
Геохимическая классификация химических элементов Вернадского основана на различной способности химических элементов участвовать в природных физических и химических процессах, а также в циклических биосферных круговоротах веществ [1].
I группа благородных (инертных) газов характеризуется неучастием их в главных химических процессах в биосфере Земли. Только в исключительных случаях эти элементы способны образовывать химические соединения.
II группа благородных металлов характеризуется тем, что они почти не образуют химических соединений в земной коре. Для этих элементов характерны сплавы друг с другом, которые образуются и образовались в термодинамических условиях (высокая температура и давление), резко отличных от условий биосферы.
III группа циклических или органогенных элементов - наибольшая по количеству элементов группа. Для элементов этой группы характерны многочисленные обратимые (циклические) химические процессы, часто проходящие при непосредственном участии живой материи. Каждый элемент этой группы дает характерные для определенной геосферы постоянно изменяющиеся соединения.
IV группа рассеянных элементов характеризуется отсутствием или редкостью образуемых ими в природе химических соединений. Для элементов этой группы основная форма нахождения в биосфере - свободные атомы, входящие в виде примесей в кристаллические решетки минералов других элементов.
V группа радиоактивных элементов характеризуется неполным их обращением в природных циклических процессах - часть атомов теряется в результате радиоактивного распада.
VI группа редкоземельных элементов выделена по признаку их тесной взаимной связи и совместного поведения в чрезвычайно различных условиях биосферы.
Таблица 1.7. Геохимическая классификация элементов по В.И. Вернадскому
| Группа элементов | Элементы | Число элементов в группе | Относительное количество элементов в группе,% |
| I.Благородные газы | He, Ne, Ar, Kr, Xe | 5.44 | |
| II.Благородные металлы | Au, Ru, Rh, Pd, Os, Ir, Pt | 7.61 | |
| III.Циклические элементы | H,Be, B, C, N, O, F, Na, Mg, Al, Si, P, S, Cl, K, Ca, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Ge, As, Se, Sr, Zr, Mo, Ag, Cd, Sn, Sb, Te, Ba, Hf, W, Re, Hg, Tl, Pb, Bi | 47,82 | |
| IV.Рассеянные элементы | Li,Sc,Ga,Br,Rb,Y,Nb, Cs,Ta,In, I | 11,95 | |
| V.Радиоактивные элементы | Po,Rn,Ra,Ac,Th,Pa, U | 7,61 | |
| VI.Редкоземельные, элементы | La,Ce,Pr,Nd,Pm,Sm Eu,Gd,Tb,Dy,Ho,Er, Tu,Yb,Lu | 16,3 |
| Период | Ряд | Группа | ||||||||||
| I | II | III | IV | V | VI | VII | VIII | |||||
| I | H | He | ||||||||||
| II | Li | Be | B | C | N | O | F | Ne | ||||
| III | Na | Mg | Al | Si | P | S | Cl | Ar | ||||
| IV | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | ||
| V | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||
| VI | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | ||
| VII | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||
| VIII | Cs | Ba | La-Lu | Hf | Ta | W | Re | Os | Ir | Pt | ||
| IX | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||
| X | Fr | Ra | Ac-Lr | Rf | Db |
| Благородные газы | Рассеянные элементы | ||
| Благородные металлы | Редкоземельные элементы (лантаноиды) | ||
| Циклические элементы | Радиоактивные элементы (актиноиды) |
Классификация В.М. Гольдшмидта основана на физико-химических принципах распределения химических элементов в различных типах природных соединений [3,7].
Таблица 1.8 - Геохимическая классификация химических элементов по В. М. Гольдшмидту
| Сидерофильные | Литофильные | Халькофиль-ные | Атмофильные | Биофильные |
| Fe, Co, Ni, Ru, Rh, Pd, Os, Ir, Pt, Au, Re, N, P, C, Ge, Sn, Ba, Al, Se, Th, U, Si, Ti, Zr, Hf, V, Nb, Ta, Cr, W, Mn, РЗЭ | O, F, Cl, Br, Fe, I, Li, Na K, Rb, Cs, Be, Mg, Ca, Sr, B, Co, Cu, Zn, Mo | S, Se, Te, As, Sb, Bi, Pb, Ga, In, Tl, Zn, Cd, Hg, Cu, Mo Ca, V, Mn, Fe | H, C, O, Cl, Br I, He, Ne, Ar, N, Kr, Xe | C, H, O, N, P, S, Cl, Br, I, B, Na, K, Mg |
| Период | Ряд | Группа | |||||||||||||||
| I | II | III | IV | V | VI | VII | VIII | ||||||||||
| I | H | He | |||||||||||||||
| II | Li | Be | B | C | N | O | F | Ne | |||||||||
| III | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||
| IV | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | |||||||
| V | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||
| VI | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | |||||||
| VII | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||
| VIII | Cs | Ba | La-Lu | Hf | Ta | W | Re | Os | Ir | Pt | |||||||
| IX | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||
| X | Fr | Ra | Ac-Lr | Rf | Db | ||||||||||||
| Халькофильные | Атмофильные | ||||||||||||||||
| Сидерофильные | Н | Биофильные | |||||||||||||||
| Литофильные | |||||||||||||||||
Классификация разработанная В.М. Гольдшмидтом в 1924 г. основана на его гипотезе об образовании оболочек Земли и представлениях о строении атомов.
В.М. Гольдшмидт исходил из предположения, что наша планета первоначально находилась в расплавленном состоянии и дифференциация элементов происходила аналогично выплавке металлов из руд. При этом на дно металлургической печи опускается тяжелый металл с плотностью около 7 (аналог земного ядра), а на поверхность всплывает легкий силикатный шлак - аналог земной коры. Между ними располагается слой сульфидов железа с примесью сульфидов других металлов ("штейн"). Так, по гипотезе Гольдшмидта, образовалось металлическое ядро Земли (сидерофильные элементы), земная кора и верхняя мантия, в которой сконцентрировались элементы, обладающие большим сродством к кислороду (литофильные элементы), и основная часть мантии из элементов с высоким сродством к сере (халькофильные элементы). Инертные газы и азот, сосредоточенные в атмосфере, он отнес к атмофильным элементам. Биофильные элементы характеризуются концентрированием в живых организмах или продуктах их жизнедеятельности.
Эти построения были также увязаны с особенностями строения атомов. Так, инертные газы имеют атомы с 8-электронной оболочкой (кроме гелия), литофильные элементы образуют ионы с 8-электронной оболочкой, халькофильные элементы образуют ионы с 18-электронной оболочкой, сидерофильные элементы образуют ионы с 8 -18- электронной оболочкой. Несмотря на то, что гипотеза Гольдшмидта об образовании оболочек Земли имеет в настоящее время лишь исторический интерес, его геохимическая классификация элементов не утратила своего значения и применяется широко.
Все многообразие форм и видов существования химических элементов в биосфере можно охарактеризовать с двух позиций [ 3 ]:
· качественной - минеральная или безминеральная форма;
· количественной - концентрированное или рассеянное состояние.
В земной коре установлено к настоящему времени около 4000 видов минеральных форм, что значительно меньше, чем количество теоретически возможных.
Между числом собственных минеральных форм (N) и кларком (Ск) химического элемента в литосфере существует корреляционная зависимость [3]:
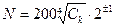
Элементы, образующие большее количество минеральных форм, чем следует по этой формуле называются минералофильными, меньше – минералофобными. Главная причина - низкие кларки многих элементов в литосфере.
Как было отмечено А.И. Перельманом [4] отличие в распространенности химических элементов в земной коре определяет различия их поведения в природе и лаборатории.
К примеру, входящие в VI группу периодической системы элементы сера S и селен Se химически близки по свойствам. Оба элемента поливалентны (S2-, S0, S4+, S6+, Se2-, Sе0, Sе4+, Sе6+), образуют соединения-аналоги — сероводород Н2S и селеноводород Н2Sе, сульфиды и селениды, сульфаты (соли Н2SO4) и селенаты (соли Н2SеO4). Вместе с тем в земной биосфере роль обоих элементов резко различна, что объясняется сравнительно высоким кларком S (4,7·10-2%) и очень низким Sе (5·10-6%). Сера S является ведущим элементом многих геохимических процессов, а селен Se - нет. Сероводород Н2S играет огромную роль в земной коре, обуславливая накопление пирита FeS2 в осадках, формирование месторождений Рb, Zn, Сu, Сd и других металлов в виде соответствующих сульфидов. Селеноводород не имеет в геохимических процессах существенного значения. Для S характерна минеральная форма нахождения, для Sе - безминеральная и т.д. Иначе говоря, геохимия S и Sе имеет меньше общих черт, чем их химия.
Различие в поведении химических элементов в образовании минеральных форм объясняется тем, что с уменьшением кларков снижается активная концентрация элементов необходимая для образования химических соединений.
К примеру, в группе щелочноземельных металлов (Mg, Ca, Sr, Ba, Ra) растворимость сульфатов уменьшается с ростом порядкового номера - наименее растворим сульфат радия RaSO4. Вместе с тем в биосфере известны минералы, представляющие собой сульфаты щелочноземельных металлов:
MgSO4
CaSO4
SrSO4
BaSO4
Но сульфат радия в виде минерала неизвестен. Причиной этого является чрезвычайно малый кларк Rа (около 2,10-10%), определяющий его низкое содержание в водах (п× 10-11 г/л), исключающее достижение произведения растворимости для RaSO4 и образование самостоятельного минерала.
Таким образом, способность к минералообразованию (количество самостоятельных минеральных видов), с одной стороны, зависит от химических свойств элемента, а с другой - от его кларка.
 2014-02-05
2014-02-05 3888
3888
