Задача.
В каком направлении произойдет смещение химического равновесия системы: N2(г) + 3H2(г) 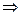 2NH3(г), ΔΗ‹ 0 – (реакция экзотермическая).
2NH3(г), ΔΗ‹ 0 – (реакция экзотермическая).
Реакция идет в прямом Реакция идет в обратном
направлении направлении


если понизить температуру t0С, если повысить t0C
увеличить давлние P уменьшить Р
увеличить концентрации увеличить
увеличить 
уменьшать  т.е.отводить NH3,
т.е.отводить NH3,
Задача. В гомогенной системе СО + Сl2 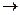 COCl2, равновесные концентрации
COCl2, равновесные концентрации 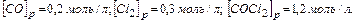 Вычислите Кр и исходные концентрации.
Вычислите Кр и исходные концентрации.
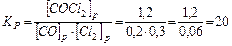 .
.
В результате реакции образовалось 1,2 моля СОСl2, учитывая коэффициенты в уравнении реакции, израсходовалось 1,2 моль/л СО и 1,2 моль/л Сl2, а так как к моменту равновесия осталось 0,2 моль/л СО и 0,3 моль/л Сl2, то

Рассматривая законы химической термодинамики, было установлено, что возможно протекание тех процессов, у которых ΔG0298<0 (Р, Т = const), а т.к. при химическом равновесии идут обратимые процессы, то какой именно процесс будет преобладать, можно определить по изменению энергии Гиббса. Мы знаем, что равновесие зависит не только от концентрации, но и от температуры и давления (для газообразных систем).
Зависимость Кр. от температуры при постоянном давлении связана с изменением ΔG0298 уравнением:
ΔG0298 = -2,3 RT lg Kр, если R = 8,31·10-3 кДж/моль·К; T = 298 K ΔG0298 = -5,7 lg Kр, кДж/моль.
Если lgKр > 0, т.е. Кр > 1, тогда ΔG0298 < 0 равновесие смещается в сторону прямой реакции.
Если lgKр < 0, т.е. Кр < 1, тогда ΔG0298 > 0 равновесие смещается в сторону обратной реакции.
»
План
1.1. Определение понятия «электролиты»
2.2. Общие представления теории электролитической диссоциации
а) степень диссоциации (a)Кд
б) константа диссоциации (aКд)
в) закон Оствальда
3.3. Электролитическая диссоциация воды
а) Kw – ионное произведение воды (Kw))
б) водородный показатель (рН)
в) индикаторы
4.4. Буферные растворы
5.5. Гидролиз
Литература
1.1. Глинка Н.Л. Общая химия: Учебное пособие для вузов. – 24-е изд., исправленное/ Под ред. В.А. Рабиновича. – Л.: Химия, 1985. – с. 225-249.
2. Общая химия. Под ред. Е.М. Соколовской, Г.Д. Вовченко, Л.С. Гузия. М., Изд-во Московского университета, 1980. – с. 239-247, с. 262-268.
3. Лучинский Г.П. Курс химии: Учебник для инженерно-технических (нехимических) вузов. – М.: Высшая школа, 1985. – с. 169-174.
Электролиты – это вещества, которые в растворе или расплаве распадаются на ионы.
Ионы – электрически заряженные частицы, способные к самостоятельному существованию в этих средах.
Электролитическая диссоциация – распад электролита на ионы под действием молекул растворителя.
Для количественной характеристики электролитической диссоциации введено понятие степени диссоциации (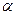 ).
).
Степень диссоциации (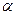 ) – это отношение числа (или концентрации С) молекул распавшихся на ионы, к общему числу (или к концентрации Сисх) молекул растворенного электролита.
) – это отношение числа (или концентрации С) молекул распавшихся на ионы, к общему числу (или к концентрации Сисх) молекул растворенного электролита.
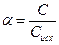
Электролиты (по заряду иона)
Таблица№12
| Бинарные или симметричные (распадаются на 2 иона) | Несимметричные |
| 1,1 валентные: NaCl à Na+ + Cl- KBr à K+ + Br- | 1,2 валентные: K2SO4 à 2K+ + SO42- |
| 2,2 валентные: MgSO4 à Mg2+ + SO42- ZnSO4 à Zn2+ + SO42- | 2,1 валентные: MgCl2 à Mg2+ + 2Cl- |
Электролиты (по степени диссоциации)
Таблица№13
Сильные 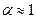 | Слабые  |
| Полностью распадаются на ионы. Обычно это соединения, кристаллическая решетка которых построена из ионов (галогениды щелочных и щелочноземельных металлов NaCl, CaBr2 и т.д.), водные растворы минеральных кислот HCl, HClO4. | Вещества частично распадаются на ионы. ¾ водные растворы NH4OH ¾ органические кислоты (уксусная кислота, пропионовая кислота) ¾ галогениды Hg(II) |
Рассмотрим более подробно разбавленные растворы слабых электролитов. При изучении растворов слабых электролитов (кислот, оснований, солей) было обнаружено некоторое отклонение от законов Вант-Гоффа и Рауля, полученных для растворов неэлектролитов. Для растворов электролитов отмечались более высокие значения осмотического давления, повышение температуры кипения и понижение температуры замерзания по сравнению с растворами неэлектролитов.
Раствор слабого электролита в результате неполной диссоциации представляет собой смесь молекул электролита, ионов электролита, молекул растворителя, между которыми отсутствует взаимодействие.
Таким образом, отступление от законов Рауля и Вант-Гоффа обусловлено тем, что количество частиц в растворе электролита вследствие неполной диссоциации больше, чем в растворе неэлектролита. Вант Гофф для растворов электролитов ввел поправочный коэффициент  (для неэлектролитов
(для неэлектролитов  =1, для электролитов
=1, для электролитов  >1), который назвал изотоническим. Уравнения для электролитов выглядят следующим образом:
>1), который назвал изотоническим. Уравнения для электролитов выглядят следующим образом:
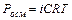


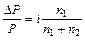
Взаимосвязь изотонического коэффициента ( ) со степенью диссоциации (
) со степенью диссоциации (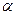 ) можно найти, используя следующие рассуждения.
) можно найти, используя следующие рассуждения.
Рассмотрим случай, когда молекула электролита распадается на 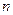 ионов (
ионов (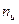 ) со степенью диссоциации
) со степенью диссоциации 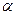 . Тогда количество ионов составляет:
. Тогда количество ионов составляет: 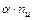 , а количество недиссоциированных молекул:
, а количество недиссоциированных молекул: 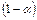 .
.
Среднее число частиц, образующихся из одной молекулы  можно записать:
можно записать:
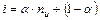 ,
,
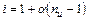 ,
,
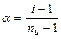 .
.
Последнее уравнение позволяет вычислить степень диссоциации слабого электролита, если изотонический коэффициент определен экспериментально (например, по изменению температуры замерзания раствора).
Итак, слабый
электролит в растворе диссоциирует на ионы, например, уксусная кислота: СН3СООН à СН3СОО- + Н+
Процесс, обратный диссоциации – рекомбинация ионов в молекулу:
СН3СООН ß СН3СОО- + Н+
С течением времени устанавливается динамическое равновесие между молекулярной и ионной формами электролита в растворе:
СН3СООН «СН3СОО- + Н+
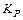 характеризует это состояние:
характеризует это состояние: 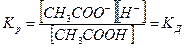
Константа диссоциации 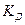 – это константа равновесия (
– это константа равновесия (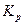 ), отвечающая диссоциации слабого электролита.
), отвечающая диссоциации слабого электролита.
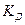 зависит от: 1.Температуры
зависит от: 1.Температуры
2. 2.Природы веществ, растворителя
2.
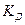 не зависит от:
не зависит от:
1.Концентрации.
Ступенчатая диссоциация характерна, для слабых многоосновных кислот (например, Н2СО3):
a) Н2СО3 «Н+ + НСО3- 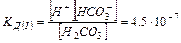 I ступень
I ступень
b) НСО3- «Н+ + СО32- 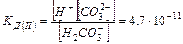 II ступень
II ступень
________________________________________________________________________________________________
Н2СО3 «2Н+ + СО32- 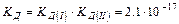
Ступенчатая диссоциация для слабых многокислотных оснований:
Fe(OH)3 «[Fe(OH)2]+ + OH- KД(I) I ступень
[Fe(OH)2]+ «[FeOH]2+ + OH- KД(II) II ступень [FeOH]2+ «Fe3+ + OH- KД(III) III ступень
______________________________________________
Fe(OH)3 «Fe3+ + 3OH- KД = КД(I) КД(II) КД(II
КД(I) > КД(II) > КД(III) (распад происходит в меньшей степени по последующим ступеням).
Взаимосвязь 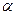 с
с 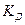 (закон разведения Оствальда).
(закон разведения Оствальда).
Сисх aС aС
Рассмотрим пример: СН3СООН «СН3СОО- + Н+
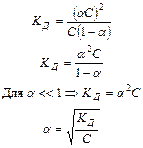
Сисх – исходная концентрация уксусной кислоты СН3СООН
aС – концентрация ионов
Сравн – равновесная концентрация уксусной кислоты
Сравн = Сисх – aС
Вывод:
1. 1.при разведении раствора, т.е. уменьшении С, a увеличивается (приближается к единице)
2. 2.при увеличении С, a – уменьшается (вероятность взаимной встречи ионов в растворе и их воссоединения в недиссоциированные молекулы увеличивается)
 2014-02-02
2014-02-02 1174
1174








