Работа по переносу электронов во внешней цепи и ионов во внутренней цепи в ГЭ равна произведению перенесенного заряда (n.F) на разность потенциалов (ΔE). Максимальное значение работы (Амах) достигается, когда ГЭ работает обратимо. В этом случае Амах=n.F. ΔE. Для станадартных условий Амах для элемента Даниеля-Якоби составляет:
Амах=n.F. ΔE=2.96500.1,1=212,46 кДж
Максимально полезная работа, которую может совершить система при протекании реакции в условиях постоянного давления и температуры, равна убыли энергии Гиббса (более подробно этот вопрс рассматривается в лекции по термодинамике).
Амах=ΔG0298
ΔG = -nFΔE,
где n – число электронов, участвующих в процессе;
F – число Фарадея;
ΔЕ – ЭДС.
Это уравнение устанавливает связь между химической и электрической энергиями. ЭДС ГЭ подобно ΔG может служить критерием равновесия и возможности самопроизвольного протекания окислительно-восстановительных реакций в определенном направлении: при этом условии – самопроизвольное протекание процесса (ΔG<0) соответствует условию ΔЕ>0. Критерием равновесия (ΔG=0) является равенство ЭДС ГЭ нулю.
|
|
|
С учетом последнего уравнение Нернста приобретает вид:
ЭДС= ΔЕ= (RT/n.F).lnKР,
Где КР- термодинамическая константа равновесия токообразующей реакции. Это выражение позволяет рассчитывать константу равновесия КР любой токообразующей ОВР.
Задача. Будет ли работать ГЭ, состоящий из никелевого электрода, погруженного в раствор NiSO4 с концентрацией 0,01 моль/л и стандартного железного электрода? Составьте схему, напишите уравнения электродных процессов, рассчитайте ЭДС и ΔG0298 элемента и сделайте вывод о возможности его работы.
Решение. Определяем потенциал электродов. Для стандартного железного электрода потенциал находим в ряду напряжений металлов.  Для никелевого электрода вычисляем потенциал по уравнению Нернста.
Для никелевого электрода вычисляем потенциал по уравнению Нернста.

следовательно в ГЭ анодом является железо, а катодом - никель.
Запишем схему ГЭ:
(-) (+)
(А) Fe │ FeSO4 ││ NiSO4 │ Ni (K)
-0,44(В) 1моль/л 10-2 моль/л -0,31(В)
Запишем уравнения электродных процессов:
 А: Fe0 - 2ē → Fe2+ окисление ЕА=-0,44 (В)
А: Fe0 - 2ē → Fe2+ окисление ЕА=-0,44 (В)
K: Ni2+ + 2ē → Ni0 восстановление ЕК=-0,31 (В)
 |
Fe + Ni2+ → Fe2+ + Ni0
 SO42- SO42-
SO42- SO42-
Fe + NiSO4 → FeSO4 + Ni
ЭДС=Е0-ЕВ=-0,31+0,44=0,13(В)
Для вычисления изменения энергии Гиббса воспользуемся формулой:
ΔG = -nFΔE= -2∙96500∙0,13 = -25090 Дж = -25,09 КДж, ΔG<0.
Этот ГЭ будет работать, хотя и имеет малую ЭДС.
Аккумуляторы – это химические источники тока многократного действия, их можно регенерировать, пропуская через них постоянный электрический ток.
Свинцовые аккумуляторы (кислотные) изготавливают из свинцовых пластин, на которые нанесен оксид свинца (PbO).
|
|
|
А Pb│ H2SO4│PbO К
Когда аккумулятор заливают серной кислотой, идет реакция:
PbO + H2SO4 → PbSO4 + H2O
Далее аккумулятор заряжают от внешнего источника постоянного тока.
 Зарядка (электролиз)
Зарядка (электролиз)
 К - Pb2+SO4 + 2ē → Pb0 + SO42- (на К- восстановление)
К - Pb2+SO4 + 2ē → Pb0 + SO42- (на К- восстановление)
+
A + Pb2+SO4 - 2ē + 2H2O → Pb+4O2 + SO42- + 4H+ (на А+ окисление)
 |
2PbSO4 + 2H2O → Pb + PbO2 + 2H2SO4
Заряженный аккумулятор можно сразу использовать по назначению. При хранении из аккумулятора надо вылить электролит, промыть водой и хранить до двух лет. Для дальнейшего использования надо залить электролит.
Разрядка. При разрядке анод и катод меняются местами.
Идут следующие реакции:
 А- Pb0 + SO42- - 2ē → PbSO4 1 +
А- Pb0 + SO42- - 2ē → PbSO4 1 +
К+ PbO2 + 2ē + SO42- + 4H+ → PbSO4 + 2Н2О 1

Pb + 2H2SO4 + PbO2 → 2PbSO4 + 2H2O
ЭДС=2,1 В.
Для промывки аккумулятора готовят раствор, в котором на 1 л 5% NH4OH берут 75 мл 2% трилона Б.
Преимущества свинцового аккумулятора:
1) большая электрическая емкость;
2) устойчивость в работе;
3) большое количество циклов зарядка-разрядка.
Недостатки:
1) большая масса;
2) выделение водорода при зарядке;
3) не герметичность при наличии концентрированного раствора серной кислоты.
Кадмиево-никелевые аккумуляторы (щелочные)
В основе их работы лежит химическая реакция:
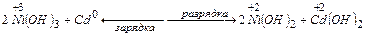 ЭДС = 1,4 В
ЭДС = 1,4 В
В аккумулятор заливают щелочной электролит, который готовят следующим образом: на 0,5 л воды берут 130 г КОН и 10 г LiOH. При зарядке идут следующие процессы:
 К - Cd2+(OH)2 + 2ē → Cd0 + 2OH- 1
К - Cd2+(OH)2 + 2ē → Cd0 + 2OH- 1
A+ 2Ni2+(OH)2 + 2OH - 2ē → 2Ni+3OOH- + 2H2O 1
 Cd2+(OH)2 + 2Ni+2(OH)2
Cd2+(OH)2 + 2Ni+2(OH)2  Cd0 + 2Ni+3OOH +2H2O
Cd0 + 2Ni+3OOH +2H2O
При разрядке:
А- Cd0 - 2ē + 2OH- → Cd(OH)2
K+ Ni2+3O3∙H2O → 2Ni+3OOH + 2H2O + 2ē → 2Ni(OH)2+ 2OH-

разрядка
 Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2
Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2
 зарядка
зарядка
В принципе, электрическую энергию может дать любая ОВР. Однако, число реакций, практически используемых в химических источниках электрического тока, невелико. Это связано с тем, что не всякая ОВР позволяет создать гальванический элемент, обладающий технически ценными свойствами (высокая и постоянная ЭДС, длительная сохранность и др.), кроме того, многие ОВР требуют расхода дорогостоящих веществ. В современных ГЭ (это устройства однократного действия) и аккумуляторах (устройства многократного действия) используют не 2, а 1 электролит. В качестве анода чаще всего используют цинк, а в качестве катода оксиды менее активных металлов. Все химические источники тока имеют два существенных недостатка:
1) высокую стоимость веществ (свинец, кадмий), из которых их изготавливают;
2) малое отношение количества энергии, которую дает элемент к его массе.
Работая над этой проблемой, пришли к созданию топливных элементов.
 2014-02-02
2014-02-02 2641
2641
