Классификация катионов
| Группа | Катионы | Групповой реагент | Краткая характеристика |
| I | Li+, K+, Na+, NH4+ | отсутствует | |
| II | Ag+, Pb2+, Hg22+ | HCl и ее соли | Хлориды нерастворимы в воде и разбавленных растворах кислот |
| III | Ba2+, Ca2+, Sr2+ | H2SO4 | Сульфаты нерастворимы в воде и разбавленных растворах Кислот. |
| IV | Al3+, Cr3+, Zn2+, As3+, As5+ | NaOH (избыток) | Гидроксиды растворимы в избытке раствора щелочи |
| V | Fe2+, Fe3+, Mn2+, Mg2+, Bi3+ | NaOH | Гидроксиды нерастворимы в избытке раствора щелочи и в растворе аммиака. |
| VI | Cu2+, Hg2+, Co2+, Ni2+, Cd2+ | NH3 водный раствор | Гидроксиды нерастворимы в избытке раствора щелочи, но растворимы в избытке раствора аммиака. С избытком реагента образуют комплексные соединения. |
Тема: «Катионы I аналитической группы»
1. Характеристика группы.
2. Частные реакции катионов первой аналитической группы.
1) Реакции на катион калия.
2) Реакции на катион натрия.
3) Реакции на катион аммония.
К первой аналитической группе катионов относятся K+, Na+, NH4+. В отличие от катионов других групп почти все соли натрия, калия, аммония хорошо растворимы в воде.
Катионы K+, Na+, NH4+. бесцветны. Гидроксиды натрия и калия – хорошо растворимы в воде и являются сильными основаниями. Гидрат аммиака NH3?H2O является слабым основанием: это нестойкое соединение, легко разлагающееся на аммиак и воду даже при комнатной температуре. Гидролизу подвергаются все соли аммония, а также натриевые и калиевые соли слабых кислот.
Аналитическим признаком катионов первой группы является отсутствие группового реагента.
Соли аммония являются нестойкими и легко разлагаются при нагревании. Это свойство используется при удалении солей аммония из смеси солей катионов первой группы.
В организме человека натрий в виде его растворимых солей (хлорида, фосфата и гидрокарбоната) содержится в основном во внеклеточных жидкостях: плазме крови, лимфе и пищеварительных соках. Осмотическое давление плазмы крови поддерживается на необходимом уровне в основном за счет хлорида натрия. Калий также содержится во всех тканях организма человека, но в отличие от натрия калий находится внутри клеток. Ион калия играет важную роль в некоторых биохимических процессах, определенная концентрация калия в крови необходима для нормальной работы сердца.
Соединения натрия, калия и аммония находят применение в фармации. Хлорид натрия входит в состав изотонического раствора и кровезаменителей, а также применяется как вспомогательное средство при изготовлении различных лекарственных препаратов. Гидрокарбонат натрия NaHCO3 применяют при повышенной кислотности желудочного сока. Салицилат натрия используют при лечении ревматизма. 10 % раствор аммиака в воде применяется для выведения больного из состояния обморока.
Частные реакции катионов первой аналитической группы
Реакции катиона калия К+
1. Реакция окрашивания пламени. Летучие соли калия окрашивают бесцветное пламя в фиолетовый цвет.
Выполнение реакции. Соль калия, лучше всего КС1, смачивают хлороводородной кислотой и вносят на тонкой платиновой или нихромовой проволоке сначала в основание пламени, а затем переводят в часть пламени с наивысшей температурой. Ионы калия окрашивают пламя в фиолетовый цвет. Вместо проволоки можно применять грифель. Даже незначительное количество солей натрия мешает определению, так как фиолетовая окраска пламени от калия совершенно маскируется желтой окраской, которую придает пламени натрий. Данная реакция является фармакопейной, т. е, применяется при анализе фармацевтических препаратов. Реакция фармакопейная.
2. Винная кислота H2C4H4O6 или гидротартрат натрия Na2HC4H4O6 при достаточной концентрации К+ в растворе дают белый кристаллический осадок гидротартрата калия.
KCl + H2C4H4O6 → KHC4H4O6↓ + HCl
KCl + NaHC4H4O6 → KHC4H4O6↓ + NaCl
K+ + HC4H4O6- → K HC4H4O6↓
В минеральных кислотах осадок растворим. Поэтому, если в качестве реагента применяют винную кислоту, реакцию ведут в присутствии ацетата натрия СНзСОONа. В этом случае образующаяся при реакции сильная кислота замещается слабой уксусной кислотой, не растворяющей осадок.
В разбавленных растворах щелочей образуются растворимые в воде средние соли. Следовательно, реакцию можно проводить в нейтральной или слабокислой среде,
Растворимость КНС4Н4О6 возрастает с повышением температуры, поэтому реакцию надо вести при охлаждении. Кроме того, этот осадок образует пересыщенный раствор; для ускорения образования кристаллов требуется механическое воздействие (трение, взбалтывание).
Ион NH4+ мешает определению, так как он образует с реактивом белый кристаллический осадок. Реакция является фармакопейной. Реакцию можно проводить микрокристаллоскопически.
3. Гексанитритокобальтат (III) натрия Na3[Co(NO2)6] осаждает из нейтрального или слабокислого раствора желтый кристаллический осадок гексанитритокобальтата (III) калия — натрия:
Na3[Co(NO2)6] + 2KC1 → K2Na[Co(NO2)6] ↓+ 2NaCl
2K+ + Na+ + [Co(NO2)]3- → K2Na[Co(NO2)6]↓
Подобный осадок получается и с солями аммония, поэтому реакцию нужно вести в их отсутствие. Для проведения реакции используют свежеприготовленный водный раствор Na3[Co(NO2)6], т. к. со временем этот реагент разлагается.
Эта очень чувствительная реакция является наиболее характерной для иона К+. Реакция является фармакопейной.
Реакции катиона натрия Na+
1. Реакция окрашивания пламени. Соли натрия окрашивают бесцветное пламя в желтый цвет. Реакция очень характерна и чувствительна, является фармакопейной.
2. Гексагидроксостибиат(V) калия K[Sb(OH)6] дает с солями натрия в строго нейтральной среде медленно образующийся белый кристаллический осадок:
NaCl + K[Sb(OH)6] → Na[Sb(OH)6]↓ + KCl
Na+ + [Sb(OH)6]- → Na[Sb(OH)6]↓
Реакцию нельзя проводить в кислой среде, так как в этом случае выделяется аморфный осадок метасурьмяной кислоты HSbO3. Нельзя проводить определение и в сильно щелочных растворах, так как в этом случае осадок не выпадает из-за повышения его растворимости. Реакцию следует проводить в достаточно концентрированном растворе.
Растворимость Na[Sb(OH)6] сильно возрастает с повышением температуры, поэтому реакцию проводят при охлаждении. Кроме того, эта соль склонна к образованию перенасыщенных растворов и для лучшей кристаллизации при проведении реакции необходимо потирать стеклянной палочкой о стенки пробирки. Присутствие аммонийных солей сильных кислот мешает определению, так как вследствие гидролиза этих солей образуется избыток ионов Н+ и может выделиться белый осадок метасурьмяной кислоты. Данную реакцию можно проводить и как микрокристаллоскопическую
3. Ацетат уранила UO2(CH3СОО)2 (микрокристаллическая реакция) образует в растворах солей натрия желтоватые кристаллы ацетат уранила-натрия (UО2) (СНзСОО)з].
NaCl + UО2 (СНзСОО)2 + СН3СООН → NaUO2 (СН3СОО) 3 + НС1
Можно в качестве реактива использовать - цинкуранилацетат Zn[(UO2)з(СН3СОО)8]
NaCl + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9H2O → NaZn[(UO2)з(СН3СОО)9] · 9Н2О↓ + HC1
Na++ Zn[(UO2)3(CH3COO)8] + CH3COO-+ 9H2O = NaZn[ (UO2)з (СН3СОО)9] · 9Н2О↓
Реакция является фармакопейной.
Эту реакцию можно проводить на предметном стекле с углублениями. К 2 каплям раствора хлорида натрия добавляют 1 каплю реактива. Наблюдают выпадение желтого кристаллического осадка.
Реакции катиона аммония NН4+
1. Гидроксиды щелочных металлов NaOH и КОН при добавлении к водному раствору соли аммония выделяют аммиак:
NН4С1 + NaOH → NaCl + NH3 ↑ + Н2О.
При нагревании раствора аммиак дан на влажную лакмусовую бумагу, аммиак взаимодействует с водой:
NH3 + H2O ↔ NH4+ + ОН-
Образующийся ион ОН- изменяет окраску лакмуса на синий цвет. При достаточной концентрации аммонийной соли выделяющийся аммиак можно обнаружить по запаху. Реакция является фармакопейной.
2. Реактив Несслера (смесь K2[HgI4] с КОН) дает с солями аммония красно-бурый осадок:

 Hg
Hg

 2K2[HgI4] + 4 KOH + NH4Cl ↔ [O NH2] I↓ +3H2O+ 7KI + KCl
2K2[HgI4] + 4 KOH + NH4Cl ↔ [O NH2] I↓ +3H2O+ 7KI + KCl
Hg
2[HgI4]2- + 4OH- + NH4+↔ [OHg2NH2]I↓ +3H2O +7I-
Ионы К+ и Na+ не мешают определению. Рекомендуется всегда приливать избыток реактива, так как образующийся осадок растворим в большом количестве аммонийных солей. Реакция очень чувствительна и является характерной для ионов аммония. Интенсивность окраски осадка зависит от концентрации ионов.
Схема анализа катионов первой аналитической группы представлена на рисунке 1.
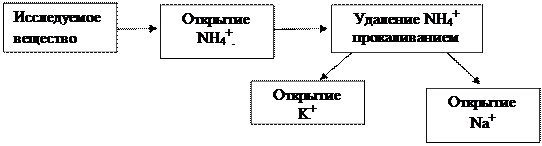 |
Рис.1. Схема анализа смеси катионов I аналитической группы
Тема: «Катионы II аналитической группы катионов»
1. Характеристика группы.
2. Частные реакции катионов второй аналитической группы.
1) Реакции на катион свинца.
3) Реакции на катион ртути (I).
Ко второй аналитической группе катионов относятся ионы Рb2+, Hg22+, Ag+. Соли этих катионов почти все плохо растворяются в воде. Хорошо растворимы только нитраты катионов этой группы, а также ацетата серебра и свинца. Катионы Рb2+, Ag+ и Hg22+ бесцветны.
Гидроксиды серебра и ртути (I) являются неустойчивые соединениями и в момент образования распадаются на соответствующий оксид и воду. Гидроксид свинца Рb(ОН)2 является трудно растворимым слабым электролитом и обладает амфотерными свойствами, т. е. при диссоциации образуют одновременно и ионы водорода Н+, и гидроксид-ионы ОН-
Pb2+ + 2OH- ↔ Pb(OH)2 + 2H2O ↔ 2H+ + [Pb(OH)4]2-
При диссоциации гидроксида свинца (II) по типу кислоты образуется комплексный ион [Рb(ОН)4]2- Этим и объясняется взаимодействие амфотерных гидроксидов с кислотами и щелочами. При добавлении к гидроксиду свинца (II) кислоты возрастает концентрация ионов водорода. Согласно правилу Ле-Шателье, диссоциация Рb(ОН)2 по типу кислоты подавляется, а по типу основания усиливается. В итоге осадок Рb(ОН)2 растворяется и образуется соль, в которой свинец является катионом:
Pb(ОН)2 + 2HNO3 → Рb(NОз)2 + 2Н2О.
При добавлении к гидроксиду свинца (II) щелочи возрастает концентрация ионов ОН-. Равновесие в системе опять нарушается, но теперь преобладает диссоциация Рb(ОН)2 по типу кислоты. Тогда реакция взаимодействия со щелочью проходит с образованием комплексной соли:
Н2 [Рb (ОН) 4] + 2NaOH → Na2 [Pb (ОН) 4] + 2H2O
или
Pb (OH)2 + 2NaOH → Na2 [Pb (OH) 4]
Соли катионов второй группы подвергаются гидролизу и их растворы имеют кислую реакцию.
Ионы Pb2+, Ag+ и Hg22+ способны образовывать комплексные соединения. Катион Ag+ образует комплексные ионы с аммиаком, CN-, SO3 2- и др. Благодаря этой способности можно переводить в раствор соли серебра (AgCl, AgBr и др.) в виде растворимых комплексных солей, что широко применяется в качественном анализе.
Групповым реагентом для второй аналитической группы являются разбавленная хлороводородная кислота или ее растворимые в воде соли. При действии группового реагента образуются белые творожистые осадки РbСl, AgCl, Hg2Cl2, причем ионы Pb2+ полностью не осаждаются.
Все растворимые соединения свинца и ртути ядовиты.
Соединения катионов второй группы находят широкое применение в медицине и фармации. Ионы серебра в очень низкой концентрации стерилизуют воду и подавляют развитие бактерий. Нитрат серебра используют при лечении глазных заболеваний. Колларгол (коллоидное серебро) применяют для промывания гнойных ран, мочевого пузыря и при гнойных конъюнктивитах. Протаргол — препарат серебра — применяют как вяжущее средство для смазывания слизистых оболочек верхних дыхательных путей. Основной ацетат свинца (II) применяется для примочек и компрессов, оксид свинца (II) РbО — для изготовления свинцового пластыря.
Частные реакции катионов второй аналитической группы
Реакции катиона свинца Рb2+
1. Хлороводородная кислота и растворимые хлориды осаждают из умеренно концентрированных растворов солей свинца (II) со слабокислой реакцией белый хлопьевидный осадок хлорида свинца (II), легко растворимый в горячей воде:
Pb(NO3)2+ 2НС1 → РЬС12↓ +2HNО3
Pb2+ + 2Cl- → РЬС12↓
2. Гидроксиды щелочных металлов КОН и NaOH
из растворов солей свинца (II) осаждают гидроксид свинца (II) — осадок белого цвета:
Pb (NO3)2 + 2КОН → Pb (ОН)2↓ + 2KNO3
Pb2+ + 2OH- → Pb (ОН)2↓
Гидроксид свинца (II) обладает амфотерными свойствами, поэтому он растворяется в разбавленной азотной или уксусной кислотах и в избытке щелочи:
Рb(ОН) 2 + 2КОН → К2[Pb (ОН)4].
3. Серная кислота H2SO4 и растворимые сульфаты выделяют из растворов свинцовых солей труднорастворимый сульфат свинца (II) — осадок белого цвета:
Pb(NO3)2 + H2SO4 → PbSO4 + 2HNO3
Pb2+ + SO42- → PbSO4↓
Осадок растворяется при нагревании в щелочах (в отличие от осадков сульфатов кальция, стронция и бария):
РbSО4 + 4КОН → К2[Pb (ОН)4] + K2SO4
Растворяется также в концентрированной серной кислоте:
РbSО4 + H2SO4 → Pb(ОНSO4)2
4. Иодид калия KI, взаимодействуя с растворами свинцовых солей, дает желтый осадок иодида свинца (II):
Pb(NO3)2 + 2KI → PbI2↓ + 2KNO3
Pb2+ + 2I- → PbI2↓
Осадок растворим в избытке реагента:
PbI2↓ + 2I- → [PbI4]2-↓
Осадок растворимый в горячей воде, но при медленном охлаждении выпадают красивые золотистые чешуйчатые кристаллы («реакция золотого дождя»).
Выполнение реакции. К 2 каплям раствора нитрата свинца (II) добавляют 2 капли раствора иодида калия. В полученный раствор с осадком добавляют 1 мл воды и 3 — 4 капли разбавленной уксусной кислоты; нагревают смесь на кипящей водяной бане в течение 2 мин, затем охлаждают содержимое пробирки под струей воды. Растворившийся при нагревании осадок иодида свинца (II) вновь выпадает в виде красивых золотистых чешуек.
Реакция часто применяется для открытия ионов Рb2+. Реакция фармакопейная.
5. Хромат калия К2СгО4 или хромат натрия выделяет из слабокислых растворов солей свинца (II) желтый осадок хромата свинца (II):
Pb(NO3)2 + К2СгО4 → PbCrO4↓ + 2KNO3
Pb2+ + СгО42- → PbCrO4↓
Осадок не растворяется в уксусной кислоте, но растворяется в азотной кислоте, в водном растворе аммиака, но растворяется в гидроксидах щелочных металлов с образованием комплексов:
PbCrO4 + 4 NaOH → 2 Na2[Pb(ОН)4] + Na2СгО4
Реакция чувствительна и является характерной для ионов Рb2+.
6. С сульфид - ионами катионы свинца дают осадок черного цвета:
Pb2+ + S2- → PbS↓
Осадок растворим в азотной кислоте. Реакция фармакопейная.
Реакции катиона серебра Ag-+
1. Хлороводородная кислота НС1 и растворимые хлориды осаждают из нейтральных и кислых растворов солей серебра в виде белого творожистого осадка хлорид серебра:
AgNO3 + HC1 → AgCl + HNO3
Ag+ + Cl- → AgCl↓
Осадок легко растворяется в избытке аммиака с образованием комплексной соли:
AgCl + 2NH3 → [Ag(NH3)2]Cl
При подкислении аммиачного раствора концентрированной азотной кислотой эта соль разрушается и вновь выпадает осадок хлорида серебра:
[Ag(NH3)2]Cl + 2HNO3 → AgCl↓ + 2NH4NO3.
Эту реакцию обычно используют для открытия иона Ag+. Она является фармакопейной.
2. Иодид калия KI образует с ионом Ag+ светло-желтый осадок AgI:
AgNO3 + KI → AgI ↓ + KNO3
Ag+ + I- → AgI↓
Иодид серебра не растворяется в растворе аммиака в отличие от хлорида серебра.
3. Хромат калия К2СгО4 из растворов солей серебра осаждает кирпично-красный хромат серебра:
2AgNO3 + К2СгО4 → Ag2CrO4 ↓ + 2KNO3
2Ag+ + CrO42- → Ag2CrO4↓
Осадок растворяется в кислотах. В концентрированном растворе аммиака растворяется сообразованием комплекса:
Ag2CrO4 + 4NH3 → [Ag(NH3)2]2 CrO4
Если реакцию проводить в щелочной среде, то вместо хромата серебра выпадает осадок оксида серебра Ag2O. В уксуснокислой среде образуется дихромат серебра Ag2Cr2O7 – красно-бурого цвета.
4. Реакция с формальдегидом – реакция «серебряного зеркала» (реакция фармакопейная).
В чистую тщательно промытую пробирку вносят 3-4 капли раствора нитрата серебра, несколько капель раствора аммиака до растворения выпавшего осадка, несколько капель разбавленного раствора формальдегида и слегка нагревают пробирку (избегать сильного нагревания!)
Ag+ + NH3?H2O → AgOH↓ + NH4+
2AgOH → Ag2O↓ + H2O
Ag2O↓ + H2O + 4 NH3 → 2[Ag(NH3)2]2+ + 2OH-
2[Ag(NH3)2]2++ HCHO + 2 H2O → Ag↓+ 2NH4+ HCHONH4 + NH3?H2O
5. C тиосульфатом натрия образует белый осадок, который быстро становится желтым, затем бурым и, наконец, черным вследствие перехода в сульфид серебра:
Na2S2O3 + 2AgNO3 → Ag2S2O3↓ + 2NaNOa
Ag2S2O3 + H2O → Ag2S↓ + H2SO4.
Осадок тиосульфата серебра Ag2S2O3 растворим в избытке тиосульфата натрия с образованием комплексных ионов [Ag(S2O3)]-. Поэтому при проведении этой реакции необходимо добавлять избыток AgNO3.
Реакции катиона ртути (I) Hg22+
1. Хлороводородная кислота НС1 и растворимые хлориды из растворов солей ртути (I) осаждают хлорид ртути (I) — осадок белого цвета (каломель):
Hg2(NO3)2 + 2HC1 → Hg2Cl2↓ + 2HNO3
Hg22+ + 2Cl- → Hg2Cl2↓
На свету осадок постепенно чернеет ч с выделением тонкодисперсной металлической ртути:
Hg2Cl2 → HgCl2 + Hg2↓
Водный раствор аммиака окрашивает осадок в черный цвет, что обусловлено образованием черной мелкораздробленной ртути:
Hg2CI2 + 2NH3 → Hg(NH2)CI↓ + Hg↓ + NH4C1.
С помощью этой реакции открывают ион Hg22+.
2. Иодид калия KI из растворов солей ртути (I) осаждает иодид ртути (I) — осадок болотно-зеленого цвета:
Hg2(NО3)2 + 2KI → 2KNО3 + Hg2I2↓
При стоянии цвет осадка изменяется вследствие образования иодида ртути (II) и металлической ртути:
Hg2I2 → HgI2 + Hg.
3. Хромат калия К2СгО4 образует с солями ртути красно – бурый осадок
Hg2(NО3)2 + К2СгО4 → Hg2CrO4↓ + 2KNO3
Hg22+ + СгО42-→ Hg2CrO4↓
Oсадок не растворим в щелочах и разбавленной уксусной кислоте.
4. Реакция со щелочами. Щелочи выделяют из растворов, содержащих катионы Hg22+, черный осадок оксида ртути
Hg22 + 2ОН- → Hg2O↓ + H2O
Осадок растворим в азотной и концентрированной уксусной кислотах.
Схема анализа смеси катионов II аналитической группы представлена на рисунке 2.
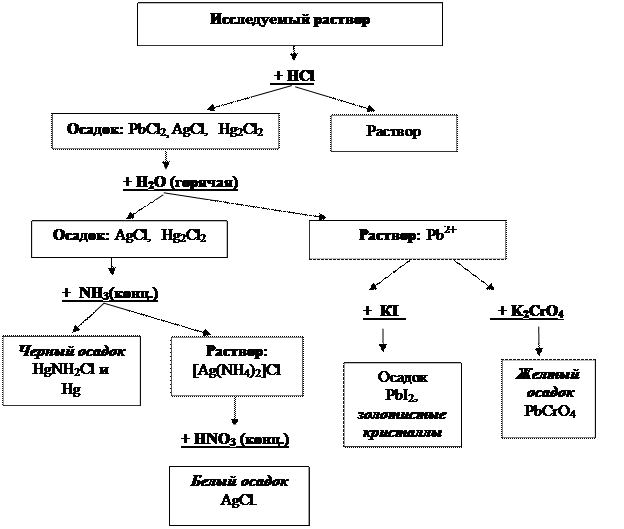 |
Рис. 2. Схема анализа смеси катионов II аналитической группы.
Тема: «Катионы III и IV аналитической группы»
1. Характеристика групп.
2. Частные реакции катионов третьей аналитической группы.
1) Реакции на катион бария
2) Реакции на катион кальция.
3. Частные реакции катионов четвертой аналитической группы.
1) Реакции на катион алюминия.
2) Реакции на катион хром.
3) Реакции на катион цинка.
К третьей группе катионов относятся ионы двухвалентных металлов Ва2+, Sr2+ и Са2+. Эти катионы бесцветны. Галогениды, нитраты и ацетаты этих катионов хорошо растворимы в воде. Гидроксиды катионов этой группы являются сильными электролитами и растворимость их уменьшается в последовательности Ва(ОН)2, Sr(OH)2, Ca(OH)2.
Сульфаты бария, стронция и кальция плохо растворимы в воде, поэтому групповым реагентом является серная кислота. Наименее растворим сульфат бария, а наиболее - сульфат кальция. Вследствие этого при добавлении серной кислоты к смеси катионов третьей группы осадок BaSO4 выделяется моментально, даже из разбавленных растворов, осадок SrSO4 спустя некоторое время, a CaSO4 только из концентрированных растворов солей кальция. Осаждение CaSO4 всегда бывает неполным.
Соли бария и кальция широко распространены в природе. Природная вода содержит в растворе соли кальция, чем обусловлена ее жесткость. Кальций является одним из основных структурных компонентов костей человека и животных. Он необходим для осуществления процесса передачи нервных импульсов, для сокращения скелетных и гладких мышц, кальций участвует в процессе свертывания крови.
Соединения кальция и бария входят в состав многих фармацевтических препаратов. Сульфат кальция (гипс) применяют при наложении повязок и изготовлении зубных порошков. Хлорид и глюконат кальция используют для лечения при аллергических заболеваниях. Сульфат бария применяется при рентгеноскопических исследованиях желудка и кишечника как контрастное средство (BaSO4 не пропускает рентгеновские лучи)
Частные реакции катионов третьей аналитической группы
Реакции катиона бария Ва2+
1. Реакции окрашивания пламени. Летучие соли бария окрашивают пламя газовой горелки в желто-зеленый цвет. Реакция является фармакопейной.
2. Разбавленная серная кислота H2SO4 и растворимые сульфаты выделяют даже из очень разбавленных растворов осадок сульфата бария:
ВаС12 + H2SO4 → BaSO4 ↓ + 2HCI
Ва2+ + SO42- → BaSO4 ↓
Осадок не растворяется в кислотах и гидроксидах щелочных металлов. За исключением концентрированной серной, в котрой он заметно растворяется с образованием гидросульфата бария:
BaSO4 + H2SO4 → Ba(НSO4)2
Реакция является фармакопейной. При нагревании с раствором карбонатов (соды) сульфат бария превращается в малорастворимый в воде карбонат, который затем растворяют в кислотах.
3. Хромат калия К2СгО4 или натрия осаждает из нейтральных или уксуснокислых растворов бариевой соли хромат бария желтого цвета:
ВаС12 + К2СгО4 → ВаСгО4↓ + 2KCI
Ba2+ + СгО4 2-→ BаСгО4↓
Осадок растворяется в минеральных кислотах, но нерастворим в уксусной ткислоте.
4. Оксалат аммония.
Ba2+ + C2O42- → BaC2O4↓
Осадок растворим в соляной и азотной кислотах, а при нагревании в уксусной.
Реакции катиона кальция Са2+
1. Реакция окрашивания пламени. Летучие соли кальция окрашивают бесцветное газовое пламя в кирпично-красный цвет. Реакция является фармакопейной.
2. Разбавленная серная кислота H2SO4 образует с ионом кальция белый осадок сульфата кальция
СаСl2 + H2SO4 → CaSO4↓ + 2HCI
Ca2+ +SO42- → CaSO4↓
Малорастворимый в воде осадок, который при медленной кристаллизации выделяется в форме игольчатых кристаллов гипса.- CaSO4?2 Н2О.
Вследствие достаточно высокой растворимости сульфата кальция (2 г/л) осаждение возможно только из достаточно концентрированных растворов солей кальция. Более полное осаждение сульфата происходит при добавлении к раствору этилового спирта.
Осадок не растворим в кислотах и щелочах, но растворяется в насыщенном водном растворе сульфата аммония.
3. Оксалат аммония (NH4)2C2O4 дает на холоду в нейтральных, уксуснокислых или слабощелочных растворах белый мелкокристаллический осадок оксалата кальция:
СаСl2 + (NH4)2C2O4 → СаС2О4↓ + 2NH4Cl
Са2+ + C2O42-→ СаС2О4 ↓
Осадок нерастворим в уксусной кислоте, но легко растворим в минеральных кислотах. Реакцию с оксалатом аммония нельзя проводить в присутствии солей бария, так как ион Ва2+ образует с оксалатом аммония белый осадок
Эта реакция наиболее важная качественная реакция на ион Са2+ и является фармакопейной.
4. Гексацианоферрат (II) калия K4[Fe(СN)6] с солями кальция образует в слабощелочной среде белый кристаллический осадок, нерастворимый в уксусной кислоте:
CaCl2 + K4[Fe(CN)6] + NH4Cl → CaKNH4[Fe(CN)6]↓ + ЗКСl
Са2++ К+ + [Fe(CN)6]4- + NH4+ → CaKNH4[ Fe(CN)6]↓
Реакция возможно в аммиачно-буферной смеси (рН = 9)
В присутствии значительных количеств иона Ва2+ не рекомендуется применять эту реакцию для открытия ионов Са2+, так как ион Ва2+ при достаточном количестве может дать осадок с K4[Fe(CN)6].
Если присутствуют ионы Са2+, то выпадает белый осадок оксалата кальция.
Схема анализа смеси катионов III аналитической группы представлена на рисунке 3.
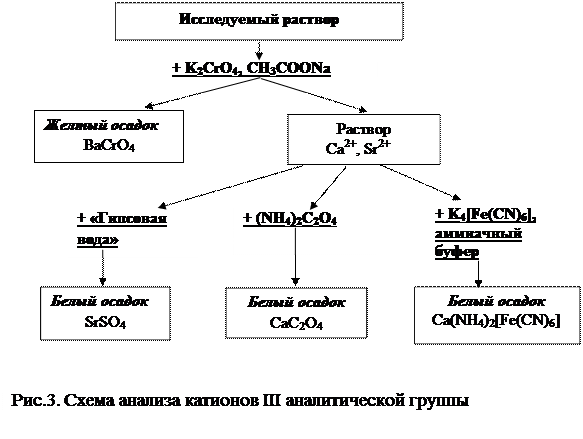
 2014-02-02
2014-02-02 36340
36340
