Лекция № 14
Дополнительная
Глоссарий
Б) Для компьютерного тестирования
А) Для письменного тестирования
Контрольные вопросы
Задание на СРСП
Задание на СРС
1. Задачи современной аналитической химии.
3. Физические методы анализа.
Д[5] с. 15-23, 29-33
2. Гравиметрический анализ. Примеры.
3. Выбор метода анализа.
Форма контроля – конспект, срок – 6 неделя. Сроки выполнения – 7 неделя. Вид задания – конспект.
1.Что изучает аналитическая химия?
2. В чем смысл качественного и количественного анализа?
3. Какие методы анализа существуют в зависимости от характера поставленной задачи?
1. Задачей качественного анализа является:
а) выяснение качественного состава вещества
б) определение количественного состава вещества
2. Задачей количественного анализа является
а) определение количественного состава вещества
б) выяснение качественного состава вещества
3. Укажите методы анализа в аналитической химии:
а) химические, физико-химические, физические
б) химические, электрические
в) физико-химические, световые
| № | Русс/каз/англ. | Пояснение |
| Аналитическая химия | Изучает качественный и количественный состав вещества | |
| Аналитикалық химия | ||
| Analytical chemistry | ||
| Анализ | Определение состава вещества | |
| Талдау | ||
| Analyze | ||
| Химические анализы | Определение состава вещества с помощью химического реагента | |
| Химиялық талдау | ||
| Chemical analyze | ||
| Физические анализы | Инструментальный метод анализа | |
| Физикалық талдау | ||
| Physical analyze | ||
| Растворимость | Способность вещества растворяться в том или ином растворителе | |
| Ерігіштік | ||
| Solubility | ||
| Растворы | Термодинамически устойчивая однородная гомогенная система переменного состава, состоящая из двух или большего числа компонентов | |
| Ерітінділер | ||
| Solutions |
Литература:
5. Пилипенко А.Л., Пятницкий И.В. Аналитическая химия. – М., 1990. – Ч. 1. – 480 с.
«Количественная характеристика растворов»
Краткое содержание лекции
Растворы – это термодинамически устойчивая однородная гомогенная система, состоящая из двух или большего числа компонентов. Важной характеристикой любого раствора является его состав, который выражается концентрацией. Рассматиривается концентрация растворов и способы ее выражения.
Процентная концентрация раствора по массе показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Процентная концентрация- это безразмерная величина и выражается соотношением
С%= 100 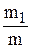 (1.30)
(1.30)
Где С- концентрация раствора, %;
m1 – масса растворенного вещества, г, кг;
m- масса раствора.
Масса раствора равна произведению объема раствора V на его плотность 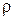 : m=V
: m=V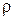 , тогда
, тогда
С%= 100 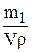 (1.31)
(1.31)
Молярная по массе концентрация раствора (молярность раствора) показывает число молей растворенного вещества, содержащихся в 1 л раствора.
Молярная концентрация (моль/л) выражается формулой
См= m/ (MV) (1.32)
Где m –масса растворенного вещества, г;
М- молярная масса растворенного вещества, г/ моль;
V- объем раствора.
Нормальная по массе концентрация раствора (нормальность раствора) показывает число грамм – эквивалентов растворенного, вещества, содержащихся в 1 л раствора (г- экв/л)
Сн= 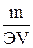 (1.33)
(1.33)
Где m- масса растворенного вещества, г;
Э- эквивалентная масса растворенного вещества, г/ экв;
V- объем раствора, л.
Моляльная (по массе) концентрация раствора (моляльность раствора) показывает число молей растворенного вещества, приходящегося на 1 кг растворителя.
Размерность моляльной концентрации
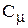 = m1/ (
= m1/ (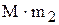 ), (1.34)
), (1.34)
где 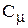 - моляльная концентрация, моль/ кг;
- моляльная концентрация, моль/ кг;
m1 – масса растворенного вещества, г;
m1- масса растоврителя, кг;
М- моль растворенного вещества, г.
Титр раствора Т показывает количество граммов растворенного вещества, содержащегося в 1 мл. раствора.
Лекцияның қысқаша мазмұны
Екі немесе одан да көп компоненттерден тұратын термодинамикалық тұрақты бір текті гомогенді жүйені ерітінділер деп атайды. Кезкелген ерітіндінің маңызды сипаттамасы концентрациямен белгіленетін оның құрамы. Ерітінділердің концентрациясы мен оны көрсету жолдары қарастырылады.
 2014-02-02
2014-02-02 3847
3847
