Константа нестойкости может служить мерой устойчивости комплекса, поскольку, чем меньше ее величина, тем более устойчивым считается комплекс. Однако такая закономерность напрямую применима только к однотипным комплексам, т.е. имеющим одинаковое число лигандов во внутренней сфере.
Иногда вместо константы нестойкости комплексов используется обратная ей величина, называемая константой устойчивости (Kуст.):
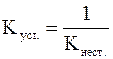 ;
; 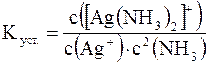 ;
; 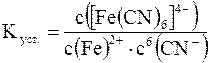
В этом случае комплексный ион считается тем более устойчивым, чем больше величина Kуст.
Комплексные ионы, содержащие в своем составе несколько лигандов, подобно слабым многоосновным кислотам или многокислотным основаниям, диссоциируют ступенчато. Каждая последующая стадия при этом протекает хуже, чем предыдущая. Общее число стадий или ступеней равно количеству лигандов во внутренней сфере.
Так, ион [Ag(NH3)2]+ диссоциирует в 2 стадии:
1) [Ag(NH3)2]+  [AgNH3]+ + NH3 K1
[AgNH3]+ + NH3 K1
2) [AgNH3]+ 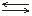 Ag+ + NH3 K2
Ag+ + NH3 K2
а ион [Fe(CN)6]4– диссоциирует в 6 стадий:
1) [Fe(CN)6]4– 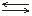 [Fe(CN)5]3– + CN– K1
[Fe(CN)5]3– + CN– K1
2) [Fe(CN)5]3– 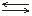 [Fe(CN)4]2– + CN– K2
[Fe(CN)4]2– + CN– K2
3) [Fe(CN)4]2– 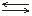 [Fe(CN)3]– + CN– K3
[Fe(CN)3]– + CN– K3
4) [Fe(CN)3]– 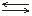 [Fe(CN)2]0 + CN– K4
[Fe(CN)2]0 + CN– K4
5) [Fe(CN)2]0 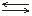 [FeCN]+ + CN– K5
[FeCN]+ + CN– K5
6) [Fe(CN)]+ 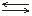 Fe2+ + CN– K6
Fe2+ + CN– K6
Каждая стадия диссоциации комплексного иона характеризуется своей константой нестойкости или устойчивости (K1, K2, …).
Общая константа нестойкости (или устойчивости) комплекса равна произведению констант нестойкости (или устойчивости) каждой из стадий. Для вышеприведенных комплексных ионов это будет выглядеть следующим образом:
Kнест.([Ag(NH3)2]+) = K1 × K2
Kнест.([Fe(CN)6]4–) = K1 × K2 × K3 × K4 × K5 × K6
Значения констант нестойкости комплексных ионов определяются опытным путем и приводятся в соответствующих справочниках (табл. 19).
При наличии в растворе нескольких лигандов, способных к образованию комплексного соединения с ионом металла, наблюдается совмещенное лигандообменное равновесие. Процессы образования комплексного соединения с каждым из лигандов являются конкурирующими: преобладающим будет процесс, который приводит к образованию наиболее прочного (т.е. с наименьшей константой нестойкости) комплексного иона. Заключение о сравнительной прочности комплексных ионов на основании величины Kнест. можно напрямую делать только для однотипных соединений (с одинаковым числом лигандов во внутренней сфере).
Таблица 19. Общие константы нестойкости некоторых комплексных ионов при 25оС
| Вид иона | Величина Kнест. | Вид иона | Величина Kнест. |
| [Co(CN)6]2– | 8,1 × 10–20 | [Ag(NH3)2]+ | 6,8 × 10–8 |
| [Cu(CN)4]2– | 2,0 × 10–30 | [Cu(NH3)2]2+ | 1 × 10–12 |
| [Fe(CN)6]3– | 1,3 × 10–44 | [Co(NH3)6]2+ | 1 × 10–5 |
| [Zn(CN)4]2– | 2,4 × 10–20 | [Pt(NH3)4]2+ | 5 × 10–34 |
| [Ni(CN)4]2– | 1,4 × 10–31 | [Zn(NH3)4]2+ | 1,3 × 10–8 |
| [Fe(CN)6]4– | 1,3 × 10–37 | [Co(NH3)6]3+ | 1 × 10–35 |
Например, если в растворе в равных концентрациях окажутся ионы Zn2+, молекулы NH3 и ионы CN–, то преимущественно образуется ион [Zn(CN)4]2–, а не [Zn(NH3)4]2+, так как Kнест. первого иона значительно меньше (табл. 19).
Существуют и такие совмещенные лигандообменные равновесия, в которых объектом конкуренции является лиганд, а конкурирующими частицами ионы металлов. Например, если в растворе будут присутствовать ионы Zn2+ и Ni2+ и цианид-ионы, то преимущественно образуется ион [Ni(CN)4]2–, а не [Zn(CN)4]2–, т.к. у первого комплекса константа нестойкости гораздо меньше (табл. 18).
В отличие от реакций ионного обмена, образование комплексных соединений часто не является мгновенным процессом. Например, разрушение иона [Co(NH3)6]3+ при добавлении кислоты полностью происходит при 20оС за несколько дней.
Гидролизом называется взаимодействие ионов соли с Н2О, приводящее к образованию слабого электролита.
Любую соль можно представить как продукт взаимодействия кислоты и основания.
В зависимости от видов этих исходных веществ выделяют 4 типа солей.
1. Соли, образованные сильной кислотой и сильным основанием:
NaOH + HCl = NaCl + H2O
сильное сильная
основание кислота
2 KOH + H2SO4 = K2SO4 + 2 H2O
сильное сильная
основание кислота
Такие соли гидролизу не подвергаются и их водные растворы имеют нейтральную среду.
2. Соли, образованные слабой кислотой, но сильным основанием:
H2CO3 + 2 NaOH = Na2СO3 + 2 H2O
слабая сильное
кислота основание
H2S + 2 KOH = K2S + 2 H2O
слабая сильное
кислота основание
В водных растворах таких солей с H2O будут взаимодействовать анионы слабой кислоты, которые образуются при диссоциации соли:
Na2СO3 ® 2 Na + + CO3 2−
Эти анионы будут присоединять к себе ионы Н+, отщепившиеся от молекул H2O, в результате этого образуется слабый электролит HСO3− - гидрокарбонат-анион, а в растворе станут накапливаться ионы ОН−, которые будут сообщать раствору такой соли щелочную реакцию.
HOH + CO32- 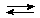 HСO3 − + OH –
HСO3 − + OH –
В результате этого рН растворов солей, образованных слабой кислотой и сильным основанием, будет > 7. А в самом растворе станут присутствовать кислая соль и щелочь.
В молекулярном виде уравнение гидролиза записывается следующим образом:
Na2СO3 + НОН 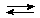 NaHСO3 + NaOH
NaHСO3 + NaOH
Взаимодействие ионов соли с H2O является обратимой реакцией и с течением времени в растворе устанавливается равновесие и при этом гидролизу подвергается только малая часть анионов соли. Чем слабее кислота, образующая соль, тем сильнее протекает гидролиз.
Если соль образована слабой многоосновной кислотой, то гидролиз может идти в несколько стадий или ступеней. Их число равно величине заряда анионов слабой кислоты. Например:
|
НОН + S2 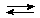 HS- + OH-
HS- + OH-
молекулярное Na2S + НОН 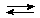 NaНS + NaОН
NaНS + NaОН
уравнение:
|
НS- + НОН 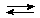 Н2 S + ОН-
Н2 S + ОН-
молекулярное NaНS + НОН 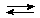 Н2 S + NaОН
Н2 S + NaОН
 2014-02-02
2014-02-02 4583
4583
