Поверхностными называются явления, которые связаны с особенностями поверхности раздела фаз. Они обусловлены поверхностной энергией и особыми свойствами дисперсных систем. Поверхностная энергия является избыточной по сравнению с энергией в объеме и сосредоточена на границе раздела фаз. Увеличение поверхности раздела в результате раздробленности дисперсной фазы приводит к росту поверхностной энергии, которая в свою очередь служит причиной интенсификации поверхностных явлений. Высокие значения поверхностной энергии и поверхностные явления – это то общее, что объединяет многочисленные дисперсные системы.
Поверхностную энергию можно определить на основе тех представлений, которые рассматривались в курсе физической химии, используя понятия о термодинамических функциях состояния, в частности об энергии Гиббса и Гельмгольца, о химическом потенциале и некоторые другие.
Поверхностные явления вызваны самопроизвольным снижением поверхностной энергии за счет уменьшения поверхностного натяжения и границы раздела фаз.
Поверхностные явления имеют место на границе раздела фаз. Фаза по Гиббсу – это совокупность частей системы, тождественных по химическому составу и термодинамическим свойствам и находящихся между собой в термодинамическом равновесии. В гетерогенных дисперсных системах дисперсная фаза и дисперсионная среда ограничены друг от друга поверхностью раздела.
Свободную поверхностную энергию на разделяющей поверхности можно представить на основе первого и второго начал термодинамики в виде изменения энергии Гиббса:
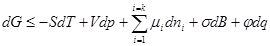
где S – энтропия; dT, dp – изменения температуры и давления соответственно; V – объем; σ – поверхностное натяжение; dB – изменение поверхности раздела фаз; μi, ni – химический потенциал и число молей компонента i; φ, q – электрический потенциал и заряд поверхности.
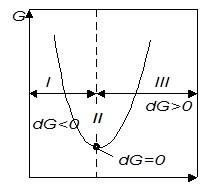
На рис 2.1 показано изменение энергии Гиббса для самопроизвольных процессов (I), в условиях равновесия (II) и для несамопроизвольных процессов (III) Когда dG < 0, то процесс будет самопроизвольным, а при dG = 0 — равновесным.
Слагаемое правой части уравнения (2.1) σdB определяет влияние на свободную поверхностную энергию изменения поверхности раздела фаз в дисперсных системах. Для гомогенной однофазовой системы это слагаемое отсутствует.
В условиях изобарно-изотермического процесса (dT = 0 и dp = 0) в отсутствие физико-химических и электростатических взаимодействий граничных фаз (dni = 0, dq = 0) из уравнения (2.1) получим:
д G = σ д B. (2.2)
Таким образом, изменение свободной поверхностной энергии определяется поверхностным натяжением σ и приращением площади раздела фаз dВ.
Из уравнения (2.2) следует, что
σ = (д G/ д В)T,p,ni,q. (2.3)
Индексы Т, р, ni и q означают, что температура, давление, число молей компонента i и электрический заряд поверхности остаются неизменными.
Если уравнение (2.1) характеризует изменение поверхностной энергии на всей разделяющей поверхности, то поверхностное натяжение в соответствии с равенством (2.3) определяет свободную поверхностную энергию в расчете на единицу площади раздела фаз. Оно эквивалентно удельной свободной поверхностной энергии.
Согласно формуле (2.3) поверхностное натяжение есть частная производная от энергии Гиббса по площади раздела фаз при постоянных температуре и давлении, в отсутствие химического, электрического и других видов взаимодействий.
Для описания изменения свободной поверхностной энергии на границе раздела фаз кроме энергии Гиббса можно использовать энергию Гельмгольца:
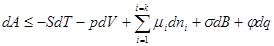 (2.4)
(2.4)
Напомним связь между характеристическими функциями:
dG= dН – TdS, (2.5)
dА = dU – TdS. (2.6)
С учетом уравнений (2.4), (2.5) и (2.6) для изохорно-изотермического процесса (dT = 0, dV = 0) при условии, что dni = 0, dq = 0, поверхностное натяжение можно выразить через изменение других термодинамических функций, состояний, а именно – энергии Гельмгольца А:
σ = (dA/dВ)T,V,ni,q, (2.7, а)
а также через изменение внутренней энергии U и энтальпии H:
σ = (dU/dВ)S,V,ni,q. (2.7, б)
σ = (dH/dВ)S,p,ni,q. (2.7, в)
В случае поверхностного натяжения относительно внутренней энергии и энтальпии энтропия должна быть неизменной, что и зафиксировано в подстрочечных индексах формул (2.7, б) и (2.7, в).
Поверхность раздела фаз обладает избытком нескомпенсированной энергии. Этот избыток в расчете на единицу поверхности и составляет удельную свободную поверхностную энергию. Удельная свободная поверхностная энергия не является особой формой энергии, а обусловлена самим положением молекул на границе раздела фаз.

Энергетический аспект поверхностного натяжения определяется работой изотермического и обратимого изменения площади поверхностного слоя в расчете на 1м2.
Жидкость всегда стремится к тому, чтобы площадь ее свободной поверхности была минимальной. Если на поверхности жидкости образуется гребень В (см. рис. 2.2), то в соответствии с условием минимальной поверхностной энергии [уравнение (2.1)] гребень исчезает и поверхность жидкости становится идеально гладкой.
Нескомпенсированное межмолекулярное взаимодействие на границе раздела фаз и между молекулами внутри жидкости обусловливает возникновение тангенциальной силы. Такая сила, рассчитанная на единицу длины периметра, ограничивающего поверхность жидкости, определяет силовой аспект поверхностного натяжения. Поверхностное натяжение жидкости на границе с газовой средой обозначено на рис. 2.2 σЖГ.
Рассмотрим, как возникает поверхностное натяжение (рис. 2.3). Для наглядности на рисунке показаны только три молекулы на поверхности раздела фаз. Молекула 2, которая первоначально может быть расположена несколько выше молекул 1 и 3, в результате взаимодействия с молекулами внутри жидкости будет расталкивать соседние молекулы с силой F. В результате возникает сила, направленная тангенциально поверхности раздела фаз σ; эта сила есть поверхностное натяжение.
Удельная свободная поверхностная энергия (энергетический аспект) и тангенциальная сила (силовой аспект поверхностного натяжения) вызваны одной и той же причиной – особым положением молекул на границе раздела фаз и нескомпенсированностью межмолекулярного взаимодействия (см. рис. 2.2).
 2014-02-02
2014-02-02 5272
5272
