Запишем КПД цикла Карно в виде уравнения: 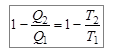 , из которого следует, что
, из которого следует, что
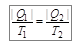 . (10.13)
. (10.13)
Если рассматривать цикл Карно с точки зрения изменений, происходящих с рабочим телом, то Q 1 и Q 2 надо приписать разные знаки, так как Q 1 – это полученное рабочим телом количества теплоты, а Q 2 – отданное. С учетом этого замечания уравнение (10.13) перепишем в виде
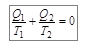 . (10.14)
. (10.14)
Величину, равную отношению теплоты Q, полученной в изотермическом процессе, к температуре тела Т, называют приведенным количеством теплоты. Соотношение (10.14) означает, что в ходе цикла Карно приведенное количество теплоты не изменяется. Напомним, что цикл Карно является обратимым. Строгий теоретический анализ показывает, что приведенное количество теплоты, сообщаемое телу в любом обратимом круговом процессе, равно нулю:
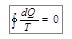 . (10.15)
. (10.15)
Равенство (10.15) позволяет утверждать, что существует некоторая величина – обозначим ее буквой S, – являющаяся функцией состояния системы. Величину S называют энтропией и вычисляют по формуле:
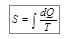 .
.
Из формулы (10.15) следует, что для обратимых процессов изменение энтропии:
dS = 0. (10.16)
В термодинамике доказывается, что энтропия системы, совершающей необратимый цикл, возрастает:
dS > 0. (10.17)
Соотношения (10.16) и (10.17) относятся только к замкнутым системам, если же система обменивается теплотой с окружающей средой, то ее энтропия может вести себя любым образом. Соотношения (10.16) и (10.17) можно представить в виде неравенства Клаузиса:
dS ³ 0. (10.18)
Неравенство (10.18) лежит в основе второго начала термодинамики: в процессах, происходящих в замкнутой системе, энтропия не убывает.
Второе начало термодинамики занимает в физике очень важное место, так как определяет направленность всех процессов. Заметим, что все реальные процессы, происходящие в природе, являются необратимыми. Для необратимых процессов в замкнутых системах энтропия, как показывают опыт и теория, всегда возрастает. И это свойство так же присуще энтропии, как энергии свойственно сохраняться при любых процессах в замкнутых системах.
Именно потому, что энергия обладает свойством сохраняться, она не может служить функцией, показывающей, в каком направлении идут процессы в замкнутой системе. Ведь при любом изменении состояния энергия в начале и конце процесса одна и та же, и поэтому она не дает возможности отличить друг от друга начальное и конечное состояния. Энтропия же, в естественно идущих процессах, всегда возрастает, что позволяет судить, какое направление процесса возможно и какое нет, какое состояние является начальным и какое – конечным.
Рост энтропии в любом процессе продолжается не беспредельно, а лишь до определенного максимального значения, характерного для данной системы. Это максимальное значение энтропии соответствует состоянию равновесия, и после того, как оно достигнуто, любые изменения в состоянии системы прекращаются.
 2014-02-02
2014-02-02 4610
4610








