Одним из важнейших понятий в электрохимии является число переноса ионов. В электролитах электричество переносится одновременно положительными и отрицательными ионами, поэтому возникает вопрос, каково участие в этом процессе ионов каждого знака.
Количество переносимого электричества определяется концентрацией ионов и скоростью их движения; когда концентрации катионов и анионов одинаковы, участие их в переносе электричества зависит лишь от относительной скорости их движения. Т.к. скорости движения катионов и анионов могут быть существенно различными, потому и числа переноса должны быть разными. Это было установлено Гитторфом (1854).
Числом переноса ионов называется доля прошедшего через электролит электричества, перенесенная данным родом ионов:
t+ = 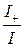 , t- =
, t- = 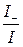 , t+ + t- =
, t+ + t- = 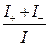 = 1
= 1
I+ = 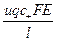 , I- =
, I- = 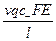 , I = I+ + I- =
, I = I+ + I- = 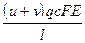
t+ = 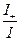 =
= 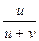 =
= 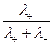 , t- =
, t- = 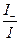 =
= 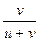 =
= 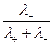
Таким образом, число переноса равно отношению скорости движения (или подвижности) данного иона к сумме скоростей движения (или подвижностей) катиона и аниона. Т.к. подвижности катиона и аниона изменяются с концентрацией и температурой в общем случае неодинаково, то и числа переноса зависят от концентрации и температуры, хотя эта зависимость более слабая.
Выведенное соотношение позволяет вычислить числа переноса, если известны значения подвижностей ионов. С др. стороны, опытное определение чисел переноса дает возможность вычислить подвижности.
Видно, что число переноса не является характеристикой только данного иона, т.к. зависит от подвижности парного с ним иона.
Экспериментально числа переноса определяются по изменению концентрации ионов у электродов (метод Гитторфа).
Рассмотрим схему движения ионов (переноса электричества) в растворе HCl при электролизе. Разделим мысленно ванну с электролитом на три отделения: I - анодная часть (анолит), II - центральная часть, III - катодная часть (католит). В процессе электролиза в отделении II концентрация электролита не изменяется, в отделениях I и III - изменяется. Схема А: до электролиза концентрация раствора во всех отделениях одинакова (в каждом из отделений находится по 6 пар ионов). Схема Б: абсолютная скорость движения Н+ приблизительно в 5 раз больше, чем скорость Cl-, поэтому в течение определенного промежутка времени при электролизе ионы Н+ пройдут слева направо путь, в 5 раз больший, чем ионы Сl- за то же время справа налево. В результате в катодном пространстве появится 6 лишних ионов водорода, а в анодном - столько же лишних ионов хлора. Схема В: эти ионы разряжаются на электродах и выделяются в виде газов. В анодном пространстве остается одна пара ионов, в катодном - 5 пар ионов. Убыль электролита у анода Dса (5 пар ионов) в 5 раз больше убыли электролита у катода Dск (1 пара ионов). Отношение Dса/Dск равно отношению абсолютных скоростей катиона и аниона и равно отношению их подвижностей.
    + Анод Катод – + Анод Катод –
– – – – – – – – – – – – – – – – – – Б + + + + + + + + + + + + + + + + + + – – – – – – – – – – – – – – – – – – В – – – + + + + + + + + + + + + + + + – – – – – – – – – – – – – – – + + +
|
 2014-02-13
2014-02-13 7286
7286



 А + + + + + + + + + + + + + + + + + +
А + + + + + + + + + + + + + + + + + +