Ионное равновесие в растворах электролитов: диссоциация воды, рН растворов, диссоциация слабых электролитов, гидролиз, буферные растворы, произведение растворимости.
Диссоциация воды протекает по схеме:
Н2О Û Н+ + ОН-
Константу диссоциации можно выразить как
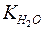 =
= 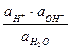
Т.к. степень диссоциации воды очень мала, то 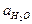 можно считать постоянной и ввести ее в значение константы диссоциации:
можно считать постоянной и ввести ее в значение константы диссоциации:
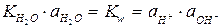
При Т = const Kw = const и не зависит от концентрации ионов Н+ и ОН-; Kw называется ионным произведением воды. При 25оС Kw = 10-14.
В нейтральном растворе 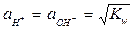 = 10-7 моль/л.
= 10-7 моль/л.
рН = - lg [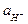 ] - водородный показатель, введенный Зеренсеном (1909). РН = 7 отвечает нейтральному раствору только при 25оС. Kw очень сильно зависит от Т (увеличивается в 100 раз в интервале 20-100оС), т.е. с ростом Т концентрация образующихся ионов Н+ и ОН- будет увеличиваться, и при t > 25оС рН = 7 будет соответствовать кислому раствору, а при t < 25оС - щелочному.
] - водородный показатель, введенный Зеренсеном (1909). РН = 7 отвечает нейтральному раствору только при 25оС. Kw очень сильно зависит от Т (увеличивается в 100 раз в интервале 20-100оС), т.е. с ростом Т концентрация образующихся ионов Н+ и ОН- будет увеличиваться, и при t > 25оС рН = 7 будет соответствовать кислому раствору, а при t < 25оС - щелочному.
Кислые растворы - такие, в которых [Н+] > [ОН-]; щелочные - [ОН-] > [Н+]. Т.к. мерой кислотности служит [Н+], то в ряду кислот более сильной будет та, у которой при одинаковой аналитической концентрации [Н+] выше (т.е. больше степень диссоциации).
Следует помнить, что величины концентраций ионов Н+ в выражении для рН можно использовать взамен активностей только в случае достаточно разбавленных растворов.
 2014-02-13
2014-02-13 1562
1562
