Тема 5. Термодинамические процессы идеальных газов в закрытых системах.
МОДУЛЬ 2. Основные термодинамические процессы в газах и их смесях
1. Возможен ли процесс, в котором теплота, взятая от горячего источни
ка, полностью превращается в работу?
2. Какой максимальный КПД тепловой машины, работающей между температурами 400 и 18оС
3. Что называется вечным двигателем первого рода?
Основными процессами, весьма важными и в теоретическом, и в прикладном отношениях, являются: изохорный, протекающий при постоянном объеме; изобарный, протекающнй при постоянном давлении; изотермический, происходящий при постоянной температуре; адиабатный — процесс, при ко-тором отсутствует теплообмен сокружающей средой, и политропный, удов-летворяющий уравнению рvn = соnst.
Метод исследования процессов, не зависящий от их особенностей и являющийся общим, состоит в следующем:
выводится уравнение процесса, устанавливающее связь между начальными и конечными параметрами рабочего тела в данном процессе;
вычисляется работа изменения объема газа;
определяется количество теплоты, подведенной (или отведенной) к газу в процессе;
определяется изменение внутренней энергии системы в процессе;
определяется изменение энтропии системы в процсссе.
Изохорный процесс. При изохорном процессе выполняется условие dv = 0 или v=соnst. Из уравнения состояния идеального газа (4) следует, что р/Т = R = v=соnst т.е.давление газа прямо пропорционально его абсолютной температуре:
р2/р1=Т2 /Т1 (41)
Работа расширения в этом процессе равна нулю, так как dv =0.
Количество теплоты, подведенной к рабочему телу в процессе 12 при cv = const, определяется из соотношений (26):
q=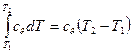 (42)
(42)
При переменной теплоемкости
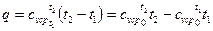 (43)
(43)
где са |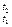 - средняя массовая изохорная теплоемкость в интервале температур от t1 до t2.
- средняя массовая изохорная теплоемкость в интервале температур от t1 до t2.
На рис. 11. представлен график процесса.

Так как t = 0, то в соответствии с первым законом термодинамики ∆u = q и
∆u = сv(Т2 – Т1) при сv = соnst;
∆u = сv |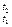 при сv = vаr (44)
при сv = vаr (44)
Поскольку внутренння энергия идеального газа является функцией только его температуры, то формулы (44) справедливы для любого термодинамического процесса идеального газа.
Изменение энтропии визохорном процессе определяется:
s2 – s1 = сv ln (Т2/Т1), (45)
т. е. зависимость энтропии от температуры на изохоре при сv = соnst имеет логарифмический характер (см. рис. 4.1).
Изобарный процесс. Из уравнения состояния идеального газа (4) при р = = соnst находим v/Т= R/р = соnst, или
v2/v1 = Т2/Т1 (46)
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре (закон Гей-Люссака, 1802 г.). На рис. 12 изображен график процесса. Из выражения 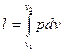 следует, что
следует, что
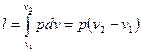 (47)
(47)
Так как pv1 = RT1 и pv2 = RT2, то одновременно
l = R(T2 – T1) (48)
Количество теплоты, сообщаемое газу при нагревании (или отдаваемое им при охлаждении), находим из уравнения (26):
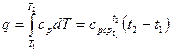 (49)
(49)
где срср - средняя массовая изобарная теплоемкость в интервале температур от t1 до t2;при ср = соnst
q = ср(t2 – t1). (50)
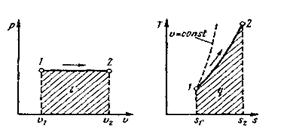 |
Рис. 12. Изображение изобарного процесса в р, v- и Т,s – координатах
Измемение энтропии при ср = соnst равно:
s2 – s1 = срln (Т2/Т1) (51)
т. е. температурная зависимость энтропии при изобарном процессе тоже имеет логарифмический характер, но поскольку ср>сv, то изобара в Т, s -диаграмме идет более полого, чем изохора.
Изотермический процесс. При изотермическом процессе температура
постоянна, следовательно, pv=RT=const, или
р2/р1 = v1/v2 (52)
т. е. давление и объем обратно пропорциональны друг другу, так что при изо-термическом сжатии давление газа возрастает, а при расширении - падает (закон Бойля — Мариотта, 1662 г.).
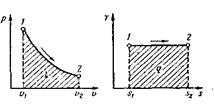 |
Графиком изотермического процесса в р,v -координатах, как показывает
уравнение (52), является равнобокая гипербола, для которой координатные оси служат асимптотами (рис.13).
Рис. 13. Изображение изотермического процесса в р, v- и Т, s –координатах
Работа процесса:
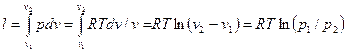 (53)
(53)
Так как температура не меняется, то внутренняя энергия идеального газа в данном процессс остается постоянной (∆u = 0) и вся подводимая к газу теплота полностью превращается в работу расширения:
q=l (54)
При изотермическом сжатии от газа отводится теплота в количестве, равном затраченной иа сжатие работе.
Из соотношений (32) и (52) следует, что изменение энтропии в изотермическом процессе выражается формулой
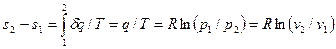 . (55)
. (55)
Адиабатный процесс. Процесс, происходящий без теплообмена с окружающей средой, называется адиабатным, т. е. δq = 0. Для того чтобы осуществить такой процесс, следует либо теплоизолировать газ, т. е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно, ибо теплообмен происходит значителыю медленнее, чсм сжатие или расширение газа.
Уравнения первого закона термодинамики для адиабатного процесса прини-мают вид: срdТ – vdр=0; сv dТ + рdv=0. Поделив первое уравнение на второе, получим
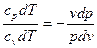 , или
, или 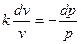
Интегрируя последнее уравнение при условии, что k = ср/сv =соnst, находим
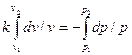 и
и 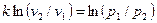 .
.
После потенцирования имеем 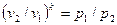 , или
, или
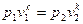 (56)
(56)
Это и есть уравнения адиабаты идеального газа при постоянном отношении теплоемкостей (k = соnst).
Величина
k= ср/сv (57)
называется показателем адиабаты. Подставив ср = сv + R, получим k = 1 +Rсv. Согласно классической кинетической теории теплоемкость газов не зависит от температуры,поэтому можно считать, что величина k также не зависит от температуры и определяется числом степеней свободы молекулы. Для одноатомного газа k =1,66, для двухатомного k =1,4, для трех- и многоатомных газов k =1,33.
Поскольку k > 1, то в координатах р, v (рис. 14) линия адиабаты идет круче линии изотермы: при аднабатном расширении давление понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается температура газа.
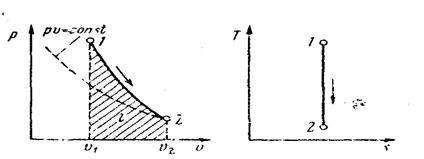
Рис. 14. Изображение адиабатного процесса в р,v- и Т,s- координатах
Определив из уравнения состояния, написанного для состояний 1 и 2, отношение объемов или давлений и подставив их в (56), получим уравнение адиа-батного процесса в форме, выражающей зависимость температуры от обьема или давления:
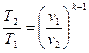 ;
;
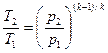 (58)
(58)
Работа расширепия при адиабатном процессе согласно первому закону термодинамики совершается за счет уменьшения внутренней энергии и может быть вычислена по одной из следующих формул:
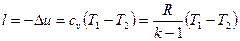 (59)
(59)
Так как при р1v1=RТ1 и р2 v2=RТ2 , то
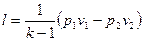 (60)
(60)
В данном процессе теплообмен газа с окружающей средой исключается, поэтому q = 0. Выражение с = δq/dТ показывает, что теплоемкость адиабатного процесса равна нулю.
Поскольку при адиабатном процессе δq = 0, энтропия рабочего тела не изме-няется (ds = 0 и s=соnst). Следовательно, на Т, s - диаграмме адиабатный процесс изображается вертикально.
Политропиый процесс и его обобщающее значение. Любой произвольный процесс можно описать в р, v - координатах (по крайней мере на небольшом участке) уравнением
рvn = соnst, (61)
подбирая соответствующее значение n. Процесс, описываемый уравнением (4.21), называется политропным. Показатель политропы п может принимать любое численное значение в пределах от - ∞ до +∞, но для данного процесса он является величиной постоянной.
Из уравнения (61) и уравнения Клапейрона нетрудно получить выражения, устанавливающие связь между р, v и Т в любых двух точках на политропе, аналогично тому, как это было сделано для адиабаты:
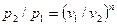 ;
; 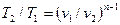 ;
; 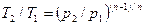 (62)
(62)
Работа расширения газа в политропном процессе имсст вид 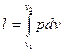 .
.
Так как для политропы в соответствии с (62)
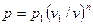 ,
,
то
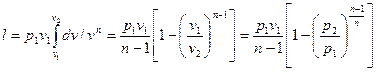 (63)
(63)
Уравнение (63) можно преобразовать к виду:
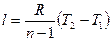 ;
;
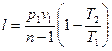 ; (64)
; (64)
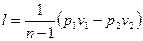
Количество подведенной (или отведенной) в процессе теплоты можно определить с помощью уравнения первого закона термодинамики: q=(u2 – u1) + l.
Поскольку u2 – u1 =сv (Т2 — Т1); 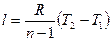 , то
, то
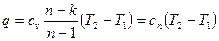 , (65)
, (65)
где
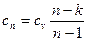 (66)
(66)
представляет собой теплоемкость идеального газа в политропном процессе. При постоянных сv, k и n теплоемкость сn = const, поэтому политропный процесс иногда определяют как процесс с постоянной теплоемкостью. Изменение энтропии
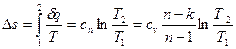 (67)
(67)
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов. Ниже приведены характеристики термодинамических процессов.
Процесс п сn
Изохорный +∞ сv
Изобарный 0 ср
Изотермический 1 ∞
Адиабатный k 0
На рис. 15 показано взаимное расположение на р, v- и Т,s - диаграммах поли-тропных процессов с разными значениями показателя политропы. Все процессы начинаются в одной точке («в центре»).
Изохора (п= ± ∞) делит поле диаграммы на две области: процессы, нахо-дящиеся правее изохоры, характеризуются положительнй работой, так как сопровождаются расширением рабочего тела; для процессов, расположенных правее изохоры, характерна отрицательная работа.
Процессы, расположенные правее и выше адиабаты, идут с подводом теп-лоты к рабочему телу; процессы, лежащие левее и ниже адиабаты, протекают с отводом теплоты.
Для процессов, расположенных над изотермой (n = 1), характерно увеличе-ние внуиренней энергии газа; процессы, расположенные под изотермой, сопро-вождаются уменьшением внутренней энергии.
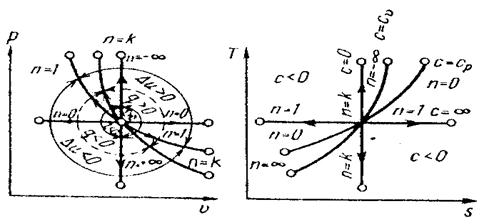
Рис. 15. Изображение основных термодинамических процессов идеального газа в р, v - и Т, s -координатах
Процессы, расположенные между адиабатой и изотермой, имеют отрица-тельную теплоемкость, так как δq и du (а следовательно, и dТ), имеют в этой области противоположные знакн. В таких процессах | l | › | q |, поэтому на произ-водство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела.
 2014-02-18
2014-02-18 7920
7920
