КЛАССИФИКАЦИЯ СРЕД ПО МЕХАНИЗМУ ИХ
Лекция N 3
Разнообразные жидкие и газообразные среды по механизму их контактного взаимодействия с твердыми телами могут быть разделены на четыре группы:
· физически-активные,
· химически-активные,
· электрохимически-активные
· радиационно-активные.
Примечание: одна и та же среда может быть физически, химически и электрохимически активной по отношению к одному конструкционному материалу и инертной к другому.
Механизм контактного взаимодействия физически-активных сред с конструкционными материалами основан на явлениях адсорбции среды на поверхности материала или ее абсорбции (поглощении) объемом материала, приводящих к изменению прочности и деформационных свойств этого материала. Подобные среды получили название сорбционно-активные.
Силы протяжения поверхностных молекул, атомов и ионов твердых тел, подобно поверхностным молекулам жидкости, не уравновешены притяжением молекул другой фазы, и результирующая сила направлена внутрь твердого тела. Вследствие этого твердые тела, так же как и жидкости, обладают определенным запасом свободной поверхностной энергии и стремятся уменьшить величину этой энергии до минимального при данных условиях значения. Этим объясняется способность твердых теладсорбировать газы и жидкости; при этом твердое тело является сорбентом, а вещество поглощаемое — сорбтивом.
Адсорбцией называется поглощение поверхностью твердого тела молекул, атомов и ионов другого вещества, находящихся в окружающей среде.
Протекание этого поверхностного процесса связано с изменением свободной поверхностной энергии. Мерой свободной поверхностной энергии единицы поверхности является поверхностное натяжение. В результате адсорбции жидких или газообразных веществ уменьшается поверхностное натяжение твердого тела. Вещество, уменьшающее поверхностное натяжение, называется поверхностно-активным.
Адсорбция происходитза счет сил межмолекулярного притяжения (ван-дер-ваальсовых), сопровождается небольшим положительным тепловым эффектом и является обратимым процессом. Ее обычно называют физической адсорбцией. В ряде случаев адсорбция сопровождается образованием поверхностных химических соединений, на образование которых нужно затратить энергию активации; такой вид адсорбции называется активированной. Этот вид адсорбции может быть необратимым. Скорость физической адсорбции при всех температурах достаточно велика и на гладкой поверхности протекает почти мгновенно, в то время как скорость активированной адсорбции резко увеличивается с повышением температуры. Поэтому при низких температурах происходит в основном физическая адсорбция, а при высоких - активированная.
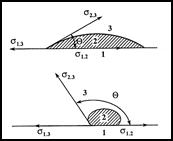
Наиболее активное молекулярное взаимодействие происходит при контакте полярных веществ с полярным материалом поверхности твердого тела и неполярных веществ с неполярным материалом поверхности, т. е. когда полярность сорбтива и сорбента одинакова. Поскольку смачиваемость поверхности твердого тела жидкостью является показателем молекулярного взаимодействия жидкости и твердого тела, то адсорбционное взаимодействие на плохо смачиваемой поверхности твердого тела будет низкое и наоборот при хорошей смачиваемости достаточно высокое. Явление смачивания заключается в том, что капля жидкости, помещенная на поверхность твердого тела, растекается. Угол Θ, образуемый поверхностью растекающейся капли с поверхностью твердого тела, называется краевым углом. Условие равновесия капли
 |
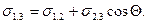
Из уравнения видно, что cosΘ является мерой избирательного смачивания, т. е. мерой полярности.
Твердое тело смачивают только тс жидкости, для которых cos Θ >0, т. е. Θ <90° и Θ1.2< Θ1.3, т. е. которые понижают поверхностное натяжение данного твердого тела на границе с воздухом. В случае смачивания молекулы жидкости испытывают сильное притяжение со стороны твердого тела, и жидкость растекается.
Наоборот, если силы притяжения между молекулами жидкости и твердого тела значительно меньше, чем между молекулами жидкости, то жидкость не смачивает поверхности.
Процесс объемного поглощения твердым телом жидкости или газа получил название абсорбция. В результате абсорбции уменьшается меж молекулярное взаимодействие в твердом теле, обусловленное более активным молекулярным взаимодействием сорбента и сорбтива. Примером абсорбции может служить поглощение металлом водорода, полимером водной среды и т. п. Следствием абсорбции полимером жидких сред является его набухание или растворение, что приводит к изменению прочности и деформационных свойств.
При объемном поглощении среды твердым телом может происходить химическое взаимодействие сорбтива с сорбентом. Подобный процесс сорбции получил название хемосорбция.
Механизм контактного взаимодействия химически-активных: сред с конструкционными материалами основан на их химическом взаимодействии по реакции Me + х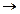 Ме х, приводящем к изменению состава и физических свойств этого материала. По отношению к металлам подобный процесс получил название химической коррозии, характеризующейся разрушением металла вследствие его непосредственной реакции со средой - неэлектролитом. Например, коррозия металлов, вызванная действием таких газов, как СО, Cl2, NH3, H2S, Н2, CO2, перегретый водяной пар или жидких неэлектролитов, например, нефти, продуктов ее переработки, расплавленной среды, органических соединений.
Ме х, приводящем к изменению состава и физических свойств этого материала. По отношению к металлам подобный процесс получил название химической коррозии, характеризующейся разрушением металла вследствие его непосредственной реакции со средой - неэлектролитом. Например, коррозия металлов, вызванная действием таких газов, как СО, Cl2, NH3, H2S, Н2, CO2, перегретый водяной пар или жидких неэлектролитов, например, нефти, продуктов ее переработки, расплавленной среды, органических соединений.
В результате взаимодействия ионов металла с кислородом на поверхности металла возникает оксидная пленка, скорость роста которой характеризует скорость коррозии и зависит от скорости химической реакции взаимодействия, скорости диффузии реагирующих веществ через пленку, скорости удаления продуктов реакции. При диффузии атомов металла сквозь пленку зоной роста будет внешняя поверхность пленки. Наоборот, если сквозь пленку диффундирует главным образом окислитель (кислород), то зоной роста пленки будет граница между пленкой и металлом. При соизмеримых скоростях встречной диффузии металла и кислорода зона роста пленки будет находиться внутри самой пленки. В связи с тем, что радиусы ионов металла заметно меньше радиуса иона кислорода, подвижность металлических ионов выше и зона роста смещается преимущественно к поверхности пленки.
Образующиеся на поверхности металла пленки тормозят коррозию.
Защитная способность этих пленок в значительной мере определяется их сплошностью. Показателем сплошности пленки служит отношение объема образующегося оксида или другого какого-либо соединения (Vокс) к объему израсходованного на образование оксида металла (Vмет), т.е. α = Vокс/ Vмет.
· При α <1 пленки не являются защитными, так как окисляющий газ свободно проникает через них к поверхности металла, вступая с ним в реакцию.
· Ориентировочно можно считать, что достаточно хорошими защитными свойствами обладают пленки при соблюдении условия
1 < α < 2,5.
· При α >2,5 пленка теряет свои защитные свойства вследствие отслаивания и растрескивания, вызываемых внутренними напряжениями из-за разности удельных объемов оксидов и металла.
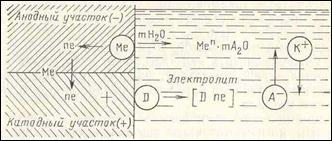
К электрохимически-активным средам относятся среды, обладающие свойствами электролита. Электрохимическая активность этих сред проявляется преимущественно при контакте с металлами и сплавами и обусловливает протекание электрохимической коррозии, представляющей собой самопроизвольный процесс разрушения металлов в электролитически проводящей среде, при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала. Разрушение металла в этом случае является результатом работы коррозионных элементов на отдельных участках поверхности металла, образующихся вследствие электрохимической гетерогенности этой поверхности.
Основными причинами электрохимической гетерогенности поверхности, обусловливающими образование на ней анодных и катодных участков, являются наличие различных примесейв металле, анизотропность кристаллической решетки, присутствие окислов и загрязнений на поверхности металла, неравномерное напряженное состояние в микрообъемах металла и др. Закономерности электрохимического поведения металлов определяются их химическим составом, составом электролита, и внешними условиями протекания процесса. В зависимости от этого возможны разные виды анодных и катодных реакций.
Наиболее типичными катодными реакциями являются восстановление водорода и кислорода.
Среды, вызывающие химическую и электрохимическую коррозию металлов и сплавов, получили название коррозионно-активные среды.
К радиационно-активным средам относятся среды, в процессе распада которых образующиеся элементарные частицы (нейтроны, протоны, дейтроны и др.) воздействуют на кристаллическую решетку конструкционного материала, вызывая изменения структуры и механических свойств, особенно в совокупности с воздействием высоких температур.
Интенсивность разрушения металлов в условиях радиации зависит от радиолизного эффекта, обусловленного изменением химического потенциала окружающей среды в результате ее радиолиза свойств металла и свойств защитной пленки на его поверхности. Основными составляющими радиоактивного излучения являются: нейтроны, протоны, дейтроны, β - частицы (тяжелые частицы), γ - частицы, α - излучение (легкие частицы).
 2014-02-09
2014-02-09 807
807






