Принципиальная схема производства разбавленной азотной кислоты
Химическая схема получения азотной кислоты
Существует два способа производства азотной кислоты:
– получение разбавленной кислоты последующим концентрированием ее в случае необходимости;
– непосредственное получение концентрированной азотной кислоты.
Наиболее распространен первый способ, что связано с использованием в народном хозяйстве как концентрированной, так и разбавленной кислоты. Методы различаются физико-химическими закономерностями протекающих процессов и технологическими схемами. Однако независимо от схемы, синтез азотной кислоты из аммиака описывается общей химической схемой:

Производство азотной кислоты из аммиака складывается из трех стадий:
Первая стадия – каталитическое окисление аммиака в оксид азота (II):
4NH3 + 5O2 = 4NO + 6H2O + Q
Вторая стадия – окисление оксида азота (II) (необходимо ↓ температуры, ↑ давления ) в оксид азота (IV) и дальнейшая димеризация оксида азота (IV) в N2O4:
а) 2 NO + O2 = 2 NO2 + Q а’) 2NO ↔ (NO)2 + Q
|
|
|
(NO)2 + O2 = 2NO2 + Q б) 2 NO2 = N2O4 + Q
Реакция а’) обратимая, повышение температуры вызывает смещение равновесия этой реакции в левую сторону. Таким образом, уменьшение скорости окисления оксида азота (II) в NO2 объясняется снижением концентрации димера.
Третья стадия – абсорбция оксида азота (IV) водой с образованием разбавленной азотной кислоты:
3NO2 + H2O = 2 HNO3 + NO + Q
Выделяющийся при этом оксид азота (II) окисляется до диоксида (IV) и снова абсорбируется.
Независимо от конкретной технологической схемы принципиальная схема производства разбавленной азотной кислоты включает 3 стадии и пять основных операций:
Первая стадия - окисление аммиака до оксида азота (II):
1-я операция: очистка аммиака и воздуха и получение аммиачновоздушной смеси;
2-я операция: окисление аммиака на катализаторе.
Вторая стадия - окисление оксида азота (II) в оксид азота (IV):
3-я операция: охлаждение нитрозных газов;
4-я операция: частичное окисление оксида азота (II) в оксид азота (IV).
Третья стадия - абсорбция оксида азота (IV) водой с образованием разбавленной азотной кислоты:
5-я операция: дальнейшее доокисление оксида азота (II) до оксида азота (IV) и одновременное образование азотной кислоты в процессе абсорбции оксид азота (IV) водой.
ПЕРВАЯ СТАДИЯ - окисление аммиака кислородом воздуха.
При окислении аммиака возможно протекание следующих процессов:
4NH3 + 4 O2 ® 2N2O + 6 H2O + Q (горение в отсутствии катализаторов)
4NH3 + 3 O2 ® 2N2 + 6 H2O + Q
4NH3 + 6 NO ® 5N2 + 6 H2O + Q
На поверхности платиновых катализаторов протекает следующая реакция:
4NH3 + 5O2 = 4NO + 6H2O + Q (**)
Протекание первых трех реакций приводит к непроизводительному расходу аммиака. Установлено, что уже при 750 °С превращение аммиака в конечные продукты достигает 100 %. В азотнокислом производстве процесс окисления производят на катализаторах, обладающих избирательностью действия, т.е. на катализаторах, обладающих избирательностью действия, - резко ускоряющих реакцию получения NO по сравнению с прочими реакциями окисления аммиака.
|
|
|
В азотнокислой промышленности в основном применяют платиновые катализаторы. Процесс окисления аммиака на платиновом катализаторе относится к числу наиболее быстрых каталитических реакций, известных в настоящее время (10-4 сек).
Реакция (**) – гетерогенная, необратимая, экзотермическая.
Выход оксида азота (II) составляет 98% при соблюдении следующих оптимальных условий:
а) температура на поверхности катализатора – 800ºС.
Повышение температуры способствует увеличению не только скорости химической реакции, но и коэффициента диффузии аммиака в смеси. Поэтому повышение температуры – эффективное средство увеличения скорости процесса окисления, протекающего как в кинетической, так и в диффузионной области. Однако повышение температуры катализа выше 800 – 850 °С быстро снижает выход NO и повышает выход элементарного азота, в том числе и за счет термической диссоциации NH3. На платиновом катализаторе поддерживают температуру от 800 °С при атмосферном давлении и до 900 °С при повышенном давлении, при котором время контакта сильно уменьшается и побочные реакции практически не успевают протекать. На низкоактивных неплатиновых катализаторах время соприкосновения необходимо увеличивать в десятки раз по сравнению с платиновым, при этом температура снижается до 700 – 750 °С.
б) Состав газовой смеси. Состав газовой смеси влияет на температурный режим и общую скорость процесса. По уравнению реакции (**) на 1 моль NH3 расходуется 1,25 моль О2, НО при таком соотношении компонентов выход оксида азота (II) не превышает 65%, т.е. очень мал.
Поэтому реакция проводится в избытке кислорода, соотношение O2:NH3 = 1.8 – 2.0; газ, поступающий на катализатор, содержит:
NH3 - 11%;
O2 – (9.5 – 10.5 %) 20%;
N2 – 70%.
Окисление протекает автотермично, если содержание аммиака в газовой смеси достигает 11%.
Следует учитывать, что при обычной температуре смесь аммиака с воздухом взрывоопасна в интервале 16-27 % NH3. При повышении температуры границы взрывоопасности расширяются.
в) Давление. Повышение давления ускоряет процесс окисления NH3, так как увеличиваются концентрации реагирующих компонентов в объеме. Кроме того,при повышенном давлении увеличивается производительность катализатора вследствие уменьшения объема газовой смеси, который обратно пропорционален давлению. НО: при повышенном давлении существенно возрастает унос мельчайших частичек платины с газом, что удорожает товарную кислоту. При повышении давления необходимо увеличивать толщину стенок аппаратуры, в результате чего возрастает ее стоимость. Поэтому применяют давления 0.2 – 1 МПа.
г) Основной промышленный катализатор окисления аммиака – платина и её сплавы с родием (Rh 4 %) или палладием ( 3 % Pd ). Платиновый катализатор применяют в виде пакетов сеток, сплетенных из тончайших проволок (диаметр 0,06 мм), сетки имеют 1024 отверстия в 1 см2. Сетки эти для создания определенного времени контактирования скрепляются в виде пакета, устанавливаемого в контактном аппарате. На 1 м2 активной поверхности контактной сетки под атмосферным давлением можно окислить до 600 кг, а при давлении 0.8 МПа – до 3000 кг аммиака в сутки. Однако при работе под давлением 0.8 МПа и выше платиновый катализатор разрушается быстрее (унос платины составляет 0.3 – 0.4 г, часть платины улавливается и регенерируется, но расходы на платину составляют значительную часть себестоимости азотной кислоты.)
|
|
|
Сейчас наряду с платиновыми катализаторами используют катализаторы из смеси оксидов железа и хрома. Контактные массы изготавливаются в виде таблеток диаметром 5 мм. Однако неплатиновые катализаторы значительно менее активны.
Окисление аммиака на платиновых катализаторах является одной из самых кратковременных каталитических реакций, известных в настоящее время (время протекания реакции 1·10-4 сек). Скорость каталитического окисления аммиака зависит от технологического режима процесса и конструкции контактного аппарата. На высокоактивных платиноидных катализаторах процесс протекает в диффузной области. На менее активных (оксидных) катализаторах при пониженных температурах и хорошем перемешивании газовой смеси окисление аммиака определяется скоростью каталитических актов, т.е. протекает в кинетической области.
С целью экономии платины применяют двухстадийное контактирование, при котором аммиак частично окисляется на платиноидных сетках, а затем доокисляется в слое неплатинового зернистого катализатора (оксиды Fe, Cr, соли Со). Если использовать двухступенчатый катализатор, состоящий из одной сетки и слоя таблеток, выход оксида азота (II) составляет 97%.
Механизм реакции, протекающей на катализаторе (Рис 4.1):
Оксида азота (II) образуется только на поверхности катализатора.
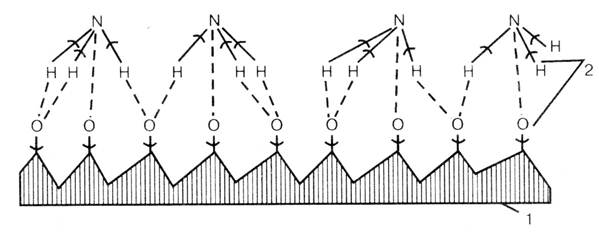
Рис. 5.1. Схема окисления аммиака на катализаторе: сплошные линии - ранее возникшие связи; пунктирные - вновь образующиеся связи.
1 - катализатор; 2 - места разрыва связей
а) Сначала атомы платины адсорбируют на себе молекулы кислорода, которые диссоциируют при этом на атомы.
б) Далее, благодаря высокому сродству кислорода к водороду, молекулы аммиака при приближении к поверхности катализатора ориентируются своими атомами водорода к атомам кислорода.
в) В результате происходит образование молекул воды и оксида азота (II), которые вытесняются новыми молекулами кислорода
Активность катализаторов может сильно понижаться вследствие отравления некоторыми примесями, имеющимися в газовой смеси, или в результате экранирующего действия механических взвесей. К наиболее сильным контактным ядам процесса окисления аммиака принадлежат соединения серы и фосфора.
|
|
|
В промышленности применяется несколько типов контактных аппаратов для окисления аммиака. Однако все они имеют приблизительно одинаковый принцип действия.
При работе под атмосферным давлением на платиноидном катализаторе в аппарате устанавливают пакет из 3–4 сеток. При повышенном давлении устанавливают до 18 сеток. При двухстадийном контактировании число платиноидных сеток может быть снижено до 1-3 (при повышенном давлении.)
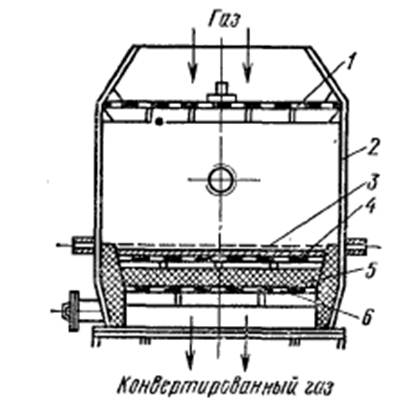 |
Рисунок 5.2. – контактный аппарат: 1 – распределительная решетка; 2 – корпус аппарата; 3 – платиноидная сетка; 4 – слой неплатинового катализатора; 5 – насадка; 6 – опорная решетка |
ВТОРАЯ СТАДИЯ процесса – окисление оксида азота (II) до оксида азота (IV) и дальнейшая частичная димеризация оксида азота (IV) до тетраоксида азота (N2O4).
Нитрозные газы, полученные при окислении аммиака, содержат около 20 об. % NO, кислород, азот и пары воды. Для получения азотной кислоты оксид азота (II) необходимо окислить до диоксида.
Это гомогенная, некаталитическая, экзотермическая реакция, протекающая с уменьшением объёма:
2NO + O2 = 2NO2. + Q
В соответствии с принципом Ле-Шателье снижение температуры и повышение давления будет сдвигать равновесие этой реакции вправо.
Было показано, что при снижении температуры ниже 100ºС, равновесие реакции было полностью сдвинуто в сторону образования оксида азота (IV) и с понижением температуры скорость реакции возрастала, т. е. для этой реакции наблюдается аномальная зависимость скорости от температуры. При 0 °С реакция протекает в 12 раз, а при 300°С – в 30 раз медленнее, чем при – 130°С.
При температуре выше 700 °С образования диоксида азота практически не происходит. Следовательно, в горячих нитрозных газах, выходящих из контактного аппарата, NO2 отсутствует, и для его получения готовую смесь необходимо охладить ниже 100 °С. Для увеличения скорости превращения NO в NO2 реакционную смесь энергично охлаждают.
!!! Известно, что для всех одностадийных химических реакций повышение температуры вызывает повышение их скорости.
Предполагают, что окисление оксида азота (II) до оксида азота (IV) идёт с образованием промежуточного продукта – димера оксида азота (N2O2), т. е. реакция протекает в две стадии:
2NO = N2O2 + Q
N2O2 + O2 = 2NO2 + Q
Поскольку реакция образования димера идёт с выделением теплоты, то с повышением температуры равновесие смещается в сторону образования оксида азота (II), а концентрация димера N2O2 уменьшается.
Понижение скорости реакции превращения оксида азота (II) до оксида азота (IV) с повышением температуры реакции можно объяснить уменьшением концентрации димера оксида азота (II).
Степень окисления NO возрастает при повышении давления. В установках, работающих под атмосферным давлением, окисление оксида азота с последующей абсорбцией NO2 водой проводят лишь на 92 – 93%, а при повышенном давлении окисляют NO и абсорбируют водой уже 98 – 99 % исходного оксида азота. Поэтому в азотнокислых цехах, работающих при атмосферном давлении, приходится устанавливать дополнительную громоздкую аппаратуру для частичного окисления и абсорбции смеси NO и NO2 щелочами. В цехах, работающих под давлением, можно ограничиться водной абсорбцией.
Одновременно в системе протекает реакция димеризации оксида азота (IV) в тетраоксид:
2NO2 = N2O4 + Q
Скорость этой реакции очень велика.
Так как эта реакция, как и две предыдущие реакции, протекает с выделением тепла и уменьшением объёма, то повышение давления и понижение температуры способствует окислению оксида азота (II) до оксида азота (IV) и димеризации оксида азота (IV).
Таким образом, в нитрозных газах поступающих на абсорбцию, содержатся NO2, N2O3, N2O4, O2, N2O, NO, N2, пары воды и др.
(Двуокись азота может взаимодействовать окись азота NO + NO2 = N2O3 + 40,2 кДж. Правда, содержание этого оксида ничтожно.)
ТРЕТЬЯ СТАДИЯ. Поглощение оксида азота (IV) и его димера водой протекает по двум следующим реакциям:
2NO2 + H2O = HNO3 + НNO2 + Q
N2O4 + H2O = HNO3 + НNO2 + Q
Получаемая при этом азотистая кислота неустойчива и разлагается:
НNO2 = HNO3 + 2NO + H2O
Суммарно взаимодействие NO2 с водой можно представить уравнением реакции:
3NO2 + H2O = 2 HNO3 + NO + Q
3N2O4 + 2H2O = 4 HNO3 + 2NO + Q
Поглощение диоксида азота водой – типичный хемосорбционный процесс в системе газ-жидкость.
Так как реакции идут с выделением тепла и уменьшением объёма, то при понижении температуры и повышении давления равновесие сдвигается в сторону образования кислоты.
В производстве необходимо получать кислоту возможно большей концентрации. При этом увеличивается давление паров оксидов азота над раствором кислоты, что снижает движущую силу процесса, и, следовательно, общую скорость процесса. Для сдвига равновесия в сторону образования HNO3 необходимо снижать температуру и повышать давление. При абсорбции оксидов азота используется принцип противотока: наиболее концентрированный газ встречается с концентрированной кислотой, а в конце абсорбции остатки NO2 поглощаются наиболее слабой кислотой.
Вследствие экзотермичности процесса абсорбции температура вытекающей продукционной кислоты обычно составляет не менее 50 °С, поэтому в установках, работающих под атмосферным давлением получается кислота, содержащая лишь 50 % HNO3. В установках, работающих под давлением 0.6 – 0.8 МПа, можно получить 58 – 60 % -ную кислоту. Поднимая давление до 5 МПа, в установках прямого синтеза HNO3 из оксидов азота и кислорода получают кислоту концентрацией 98 % HNO3.
Кроме температуры и давления равновесное состояние в этой реакции зависит от концентрации образующейся азотной кислоты.
Чем меньше концентрация образующейся азотной кислоты, тем больше степень превращения оксида азота (IV) и его димера в азотную кислоту.
Наоборот, с повышением концентрации кислоты степень превращения оксида азота (IV) уменьшается.
!!! Следовательно, при нормальных условиях можно получить только разбавленную азотную кислоту с концентрацией до 47 – 50%.
Для увеличения концентрации кислоты необходимо повысить давление, понизить температуру и увеличить содержание оксида азота (IV).
 2014-02-24
2014-02-24 22298
22298