При многих химических процессах получается смесь различных жидкостей, которую необходимо разделить на чистые компоненты. Процесс разделения основан на различной упругости пара компонентов. Способы разделения подобных смесей делятся на 2 группы:
1. Дистилляция: простая перегонка, перегонка под вакуумом, перегонка с водяным паром.
2. Ректификация.
Простая перегонка применяется для разделения легколетучих и нелетучих жидкостей. Перегонка под вакуумом и с водяным паром применяется от разделения нелетучей и малолетучей жидкости.
Ректификация – способ разделения жидкостей, растворимых друг в друге и обладающих примерно одинаковой летучестью.
Дистилляции подвергаются смеси жидкостей, организующие при следующем типы диаграмм состояния.
1. с простой эвтектикой
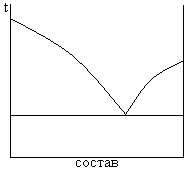
жидкости нерастворимы друг в друге
2. с областью расслаивания
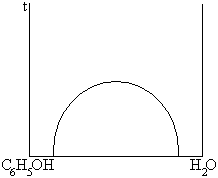
жидкости частично растворимы друг в друге
Ректификации подвергаются смеси жидкостей, неограниченно растворимых друг в друге и имеющие следующие типы диаграмм состояния:
1. сигарообразные
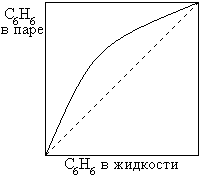
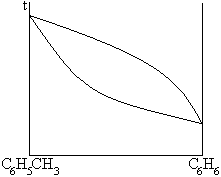
2. дающие азеотропные смеси
| ВКТ | 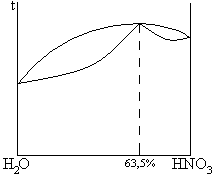 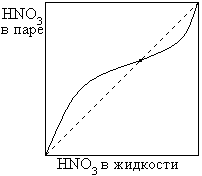
|
| НКТ | 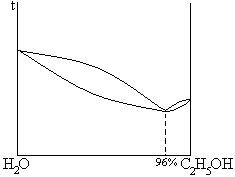 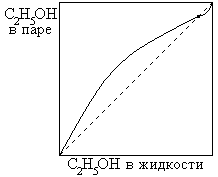
|
Подобные растворы приближаются к идеальным, и равновесие в них между жидкостью и паром описывается законом Рауля.
Если рассмотрим систему
А+В А – легколетучий, В – труднолетучий
Рn = РаХа
Рв = Ра(1–Ха)
Роб. = Ра+Рв = РаХа+Рв (1-Ха)
Рn – парциальное давление А
Ра – упругость чистого А
Ха – мольная доля А в смеси
То есть при температуре t = const парциальное давление компонентов, а также общее давление паров смеси находится в линейной зависимости от мольной доли лекголетучего компонента в смеси.
На основании этого закона и диаграммы состояния компонентов и проводится Ректификация.
 2014-02-24
2014-02-24 1214
1214








