Классификации способов тепловой обработки строительных изделий
Таблица 1.1
| Методы тепловой обработки | Назначение | В производстве каких изделий применяется | Процессы, проходящие в материале при данном методе тепловой обработки |
| Тепловлажностная обработка | Ускорения твердения | Бетонных, железобетонныхи силикатных материалов | Тепло и массообменные, химические и структурообразование |
| Сушка | Удаление влаги | Сырья и готовой продукции при производстве бетонных, железобетонных, керамических и теплоизоляционных материалов | Тепло и массообменные, химические и структурообразование |
| Обжиг | Получения спекшегося черепка | Керамических и теплоизоляционных | Тепло и массообменные, фазовые, химические и структуро-образование |
| Вспучивание | Получение высоко-пористой структуры | Легких заполнителей бетона | Тепло и массообменные, фазовые, химические и структуро-образование |
| Спекание | Получение пористой структуры | Легких заполнителей бетона | Тепло и массообменные, фазовые, химические и структуро-образование |
| Плавление | Получение расплава материала | При получении стеклянной и минеральной ваты | Тепло и массо-обменные, фазовые, химические и структуро-образование |
Тема лекции 2 Основные понятия технической термодинамики
Техническая термодинамика – наука о тепловой энергии и её свойствах, о процессах взаимного преобразования теплоты и работы.
Превращение тепловой энергии в работу (т.е. в механическую энергию) происходит в разнообразных теплотехнических устройствах – в тепловых двигателях, в паросиловых установках и др. Так, например, в двигателях внутреннего сгорания при воспламенении горючей смеси топлива и воздуха образуются газообразные продукты сгорания, имеющие высокую температуру и давление и способные совершать механическую работу – при расширении перемещать поршень в цилиндре. Другим примером преобразования тепловой энергии служит работа паросиловой установки, состоящей из парового котла, паровой турбины и электрогенератора. Пар, который вырабатывается в паровом котле, попадая на лопасти паровой турбины совершает механическую работу – вращает ротор паровой турбины и закреплённый на одном валу с ним ротор электрогенератора.
Из рассмотренных примеров видно, что превращение тепловой энергии в механическую работу совершается при помощи вспомогательного тела. (продуктов сгорания или водяного пара), которое называют рабочим телом.
Наиболее подходящими по своим физическим свойствам рабочими телами являются газы, так как именно они обладают наибольшей способностью к расширению, при котором, собственно, и совершается работа.
Теоретическое изучение термодинамических свойств газов с учётом сил межмолекулярного сцепления и объёма самих молекул – чрезвычайно сложная задача. Поэтому в теплотехнике, при изучении термодинамических процессов, пользуются понятием «идеальный газ». Идеальным называется такой газ, между молекулами которого отсутствуют силы межмолекулярного сцепления, а сами молекулы представляют собой материальные точки, не имеющие объема. Такое допущение в большинстве практических случаев оправдано, ибо в действительности в газах, далеких от состояния жидкости, силами межмолекулярного сцепления и объемом самих молекул, ввиду незначительности, можно пренебречь. Те газы и пары, для которых нельзя пренебречь силами межмолекулярного сцепления и объёмом самих молекул называют реальными газами.
Для определения конкретных физических условий, при которых рассматривается вещество, используются, так называемые, параметры состояния: температура, давление, удельный объём или плотность.
Температура (T,t) – параметр, характеризующий тепловое состояние вещества. Значение этого параметра обусловливается средней кинетической энергией поступательного движения молекул вещества. Основной единицей измерения температуры является «Кельвин» (К). Наряду с ней в настоящее время широко используется такая единица измерения температуры, как «градус Цельсия» (0С). Соотношение между температурами, выраженными в кельвинах и градусах Цельсия определяется уравнением:
T(K)=t(0C)+273,15. (2.1)
Давление (P) – параметр определяемый как результат ударов молекул вещества (газа или жидкости) о стенки сосуда, в который это вещество заключено. Основной единицей измерения давления является «Паскаль» (Па), представляющий собой давление силы в 1 ньютон на поверхность в 1 м2 (1 Па= 1н/ м2 ).
В теплотехнике пользуются понятием абсолютного (Pа), избыточного (Pи) и вакуумметрического (Рв) давлений.
Абсолютное давление – полное давлении, под которым находится вещество:
Pа= Ри+Рб , (2.2)
где Рб – барометрическое (атмосферное) давление.
Избыточное давление – разность между абсолютным давлением, большим атмосферного, и атмосферным давлением:
Ри=Ра-Рб., (2.3)
Вакуумметрическое давление – разность между атмосферным давлением и абсолютным давлением, меньшим атмосферного:
Рв=Рб-Ра. (2.4)
Удельный объём (υ)– тот объем, который занимает единица массы вещества:
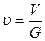 , (2.5)
, (2.5)
где V – полный объём вещества, м3;G – масса вещества, кг.
Единица измерения удельного объема – (м3/кг)
Плотность (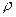 ) – масса единицы объема вещества:
) – масса единицы объема вещества:
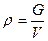 , (2.6)
, (2.6)
Единица измерения плотности – (кг/м3).
Связь между параметрами состояния P, 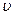 и Т устанавливается уравнением состояния газа или характеристическим уравнением, которое имеет вид:
и Т устанавливается уравнением состояния газа или характеристическим уравнением, которое имеет вид:
- для единицы массы газа (для 1 кг):
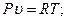 (2.7)
(2.7)
- для произвольной массы газа G:
 Pv=GRT. (2.8)
Pv=GRT. (2.8)
В этих уравнениях R- газовая постоянная, Дж/(кгК).
Численное значение газовой постоянной есть величина характерная для каждого конкретного газа, зависящая только от его химического состава:
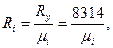 (2.9)
(2.9)
где Rу =8314 Дж/(кмоль К) – «универсальная» газовая постоянная;
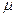 i – молекулярная масса конкретного газа.
i – молекулярная масса конкретного газа.
Из характеристического уравнения могут быть получены основные газовые законы:
а) закон Бойля-Мариотта (при T=const):
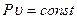 или
или 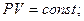 (2.10)
(2.10)
б) закон Гей-Люссака (при P=const):
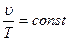 или
или 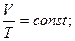 (2.11)
(2.11)
в) закон Авагадро (при T= const, P=const, V=const):
N1=N2, (2.12)
где N1 и N2 - число молекул двух разных газов, занимающих одинаковый объем, при одинаковых значениях температуры и давления.
В большинстве практических случаев рабочими телами являются не отдельные газы, а их смеси (воздух, продукты сгорания различных топлив, природные и искусственные газы). Характерно, что законы идеальных газов справедливы для газовых смесей в той же мере, что и для отдельных газов.
Контрольные вопросы:
1. Принципы преобразования тепловой энергии в механическую.
2. Что такое «рабочее тело», «идеальный газ» и «реальные газы»?
3. Характеристика параметров состояния – температуры, давления, удельного объёма и плотности.
4. Основные газовые законы.
Первый закон термодинамики – частный случай всеобщего закона сохранения и превращения энергии, определяющий условия превращения теплоты в работу или работы в теплоту. Смысл его сводится к следующему: если затрачивается некоторое количество тепловой энергии, то возникает эквивалентное количество механической энергии, за счёт которой совершается определенная работа и наоборот, при затратах некоторого количества механической энергии, за счёт которой совершается определенная работа, выделяется эквивалентное количество теплоты.
При определении количества затрачиваемой теплоты пользуются понятием теплоемкости.
Теплоемкость – это то количество теплоты, которое необходимо затратить для нагрева количественной единицы вещества (1 кг, 1м3, 1 кмоля) на один градус. В зависимости от выбранной количественной единицы вещества различают массовую
(C, кДж/(кгК)), объёмную (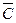 , кДж/(м3К))и киломольную (
, кДж/(м3К))и киломольную (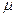 С, кДж/(кмоль*К)) теплоёмкости. Между ними имеют место следующие соотношения:
С, кДж/(кмоль*К)) теплоёмкости. Между ними имеют место следующие соотношения:
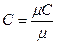 ;
; 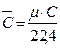 ;
; 
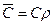 . (3.1)
. (3.1)
В теплотехнике пользуются понятиями средней и истинной теплоемкости.
Если для нагревания количественной единицы газа от температуры t1 до температуры t2 затрачивается количество теплоты q, то величина
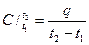 (3.2)
(3.2)
будет представлять собой среднюю теплоёмкость газа в интервале температур от t1 до t2.
Чем меньше интервал температур t1 - t2 , тем ближе значение теплоёмкости к её истинной величине. Таким образом, для истинной теплоёмкости справедлива зависимость:
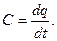 (3.3)
(3.3)
Согласно уравнению (14), количество теплоты, сообщенное 1 кг газа определится как:
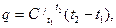 (3.4)
(3.4)
а количество теплоты, сообщенное G кг газа – как
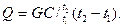 (3.5)
(3.5)
Следует отметить, что количество теплоты, затрачиваемой на нагрев газа (или отводимой от газа при его охлаждении), зависит от условий, при которых осуществляется подвод (или отвод) теплоты.
Наиболее характерными условиями нагревания или охлаждения газов в теплотехнике являются:
а) нагревание (или охлаждение) газа при V= const;
б) нагревание (или охлаждение) газа при P=const.
Специальные эксперименты показывают, что значение теплоемкости газа, полученное в процессе нагревания (охлаждения) при V= const (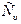 -изохорная теплоёмкость) отличается от значения теплоемкости газа, полученного в процессе нагревания (охлаждения) при P=const (Сp – изобарная теплоёмкость). Такое отличие объясняется следующим образом. Например, при нагревании 1 кг газа на 1оС при V= const сообщаемая газу теплота (теплоемкость
-изохорная теплоёмкость) отличается от значения теплоемкости газа, полученного в процессе нагревания (охлаждения) при P=const (Сp – изобарная теплоёмкость). Такое отличие объясняется следующим образом. Например, при нагревании 1 кг газа на 1оС при V= const сообщаемая газу теплота (теплоемкость 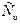 ) расходуется только на увеличение его внутренней энергии (газ нагревается), так как внешняя работа при этом не совершается. При нагревании же 1 кг газа на 1оС при P=const объём газа возрастает и сообщенная газу теплота (теплоёмкость Cp) расходуется не только на увеличение внутренней энергии газа, но и на совершение работы расширения. Поэтому теплоёмкость Cp всегда больше теплоёмкости
) расходуется только на увеличение его внутренней энергии (газ нагревается), так как внешняя работа при этом не совершается. При нагревании же 1 кг газа на 1оС при P=const объём газа возрастает и сообщенная газу теплота (теплоёмкость Cp) расходуется не только на увеличение внутренней энергии газа, но и на совершение работы расширения. Поэтому теплоёмкость Cp всегда больше теплоёмкости 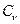 на величину работы, совершаемой 1 кг газа при нагревании его на 1оС при постоянном давлении. Связь между этими теплоёмкостями устанавливается уравнением Майера:
на величину работы, совершаемой 1 кг газа при нагревании его на 1оС при постоянном давлении. Связь между этими теплоёмкостями устанавливается уравнением Майера:
Cp- 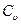 = R. (3.6)
= R. (3.6)
Теплоёмкости смеси газов могут быть определены по уравнениям:
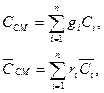 (3.7)
(3.7)
где Ci и 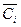 – соответственно, массовая и объёмная теплоемкости i- го газа.;
– соответственно, массовая и объёмная теплоемкости i- го газа.;
gi и ri – соответственно, массовая и объёмная доли i-го газа.
Газ, как и всякое тело, обладает определённой внутренней энергией (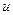 ), которая складывается из внутренней кенетической (uk) и внутренней потенциальной (uп) энергии мельчайших его частиц (атомов и молекул).
), которая складывается из внутренней кенетической (uk) и внутренней потенциальной (uп) энергии мельчайших его частиц (атомов и молекул).
Величина uk зависит от скорости движения частиц газа, и, следовательно, зависит от его температуры. Величина uп зависит от сил взаимодействия частиц газа и их взаимного расположения и, следовательно, зависит от его давления и удельного объема при данной температуре.
Таким образом, для реальных газов (с учётом их определения):
u=f(P, 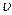 , T), (3.8)
, T), (3.8)
а для идеального газа (с учётом его определения):
u=f(T). (3.9)
Изменение внутренней энергии (∆u= u2 – u1) для реальных газов будет определяться как сумма изменения внутренней кинетической (∆uk) и внутренней потенциальной (∆uп) энергии:
∆u= u2-u1=∆uк +∆uп, (3.10)
где u1 и u2 - соответственно, начальное и конечное значения внутренней энергии газа.
Для идеального газа, у которого отсутствуют силы межмолекулярного сцепления и, следовательно, ∆uп =0 изменение внутренней энергии определяется как:
∆u= u2-u1=∆uк (3.11)
и будет зависеть только от начальной T1 и конечной T2 температур газа и не будет зависеть от характера протекания процесса:
∆u= u2-u1=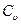 (T2-T1). (3.12)
(T2-T1). (3.12)
При осуществлении всех термодинамических процессов (за исключением процессов, происходящих при V= const) при передаче газу теплоты изменяется не только его внутренняя энергия, но и совершается внешняя работа при расширении газа, величина которой определяется по уравнениям:
для 1 кг газа
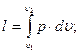 (3.13)
(3.13)
для G кг газа
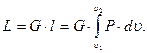 (3.14)
(3.14)
Интегралы в уравнениях (25) и (26) могут быть определены только в том случае, если будет известна функциональная зависимость P=f(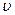 ). Это означает, что величина произведённой газом работы зависит от характера протекания термодинамического процесса. Таким образом, если к газу подводится (или от газа отводится) теплота, то в общем случае часть её израсходуется на изменение внутренней энергии газа, а часть – на совершение внешней работы. В этом случае математическое выражение первого закона термодинамики приобретает вид: для 1кг газа
). Это означает, что величина произведённой газом работы зависит от характера протекания термодинамического процесса. Таким образом, если к газу подводится (или от газа отводится) теплота, то в общем случае часть её израсходуется на изменение внутренней энергии газа, а часть – на совершение внешней работы. В этом случае математическое выражение первого закона термодинамики приобретает вид: для 1кг газа
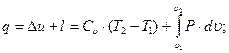 (3.15)
(3.15)
для G кг газа
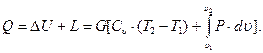 (3.16)
(3.16)
Для бесконечно малого изменения состояния рабочего тела (газа) уравнение первого закона термодинамики имеет вид:
dq=du+dl. (3.17)
При описании различных термодинамических процессов, кроме рассмотренных уже параметров состояния (температура, давление, удельный объем или плотность) пользуются дополнительными параметрами состояния – энтальпией и энтропией.
Энтальпия (i) – количество теплоты, затрачиваемой на нагревание количественной единицы вещества (1кг или 1 м3) от абсолютного нуля или от 00С до температурыT(K) или, соответственно, t0C при постоянном давлении:
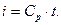 (3.18)
(3.18)
Энтропия (S) – величина, изменение которой (∆S) в любом термодинамическом процессе равно отношению теплоты ∆q, затраченной на осуществление этого процесса к абсолютной температуре рабочего тела:
 (3.19)
(3.19)
или в дифференциальной форме:
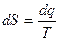 . (3.20)
. (3.20)
Контрольные вопросы:
1. Теплоемкость. Виды теплоемкости.
2. Внутренняя энергия рабочего тела и её изменение.
3. Определение внешней работы, совершаемой рабочим телом.
4. Сущность первого закона термодинамики и его материальное выражение.
5. Энтальпия и энтропия, как параметры состояния рабочего тела.
 2014-02-24
2014-02-24 1716
1716
