Термодинамический процесс – это процесс перехода рабочего тела (газа или пара) из одного состояния начального в другое (конечное) состояние.
Изучение термодинамических процессов начинается с рассмотрения четырех основных процессов изменения состояния идеального газа:
1) изохорного, протекающего при постоянном объеме;
2) изобарного, протекающего при постоянном давлении;
3) изотермического, протекающего при постоянной температуре;
4) адиабатного, протекающего без теплообмена с окружающей средой.
Затем рассматривают обобщающий процесс – политропный, по отношению к которому все вышеперечисленные процессы являются частными случаями.
Изохорный процесс (процесс, протекающий при 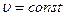 ).
).
Графическое изображение процесса в P- υ координатах показано на рисунке 4.1.
Связь между параметрами находится из характеристических уравнений для начального и конечного состояния газа:
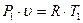 и
и 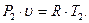
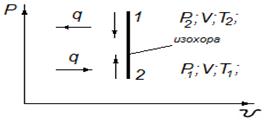
Рисунок – 4.1
Разделив первое уравнение на второе и произведя сокращение, получим:
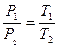 (4.1)
(4.1)
|
Далее, в соответствии с уравнением (24), изменение внутренней энергии в этом процессе определится как:
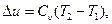 (4.2)
(4.2)
а теплота, необходимая для осуществления этого процесса, в соответствии с уравнением (27) и с учётом того, что l=0, определится как:
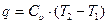 . (4.3)
. (4.3)
Изобарный процесс (процесс, протекающий при P=const).
Графическое изображение процесса в P- υ - координатах показано на рисунке 4.2.
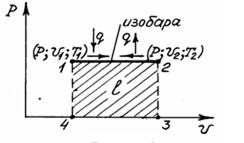
Рисунок – 4.2
Связь между параметрами находится из характеристических уравнений для начального и конечного состояний газа:
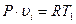
и 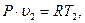
откуда 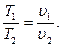 (4.4)
(4.4)
|
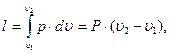 (4.5)
(4.5)
т.е. определяется заштрихованной площадью 1-2-3-4-1, расположенной под линией процесса.
Если в уравнение (37) подставить вместо 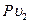 и
и 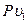 их значения из уравнений состояния газа
их значения из уравнений состояния газа 
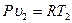 и
и 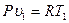 , то получим:
, то получим:
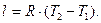 (4.6)
(4.6)
Изменение внутренней энергии газа в изобарном процессе будет определяться точно так же, как и в изохорном процессе – в соответствии с уравнением (24):
∆u=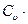 (T2-T1), (4.7)
(T2-T1), (4.7)
а теплота, необходимая для осуществления этого процесса, в соответствии с уравнением (27) и с учётом уравнений (38) и (39), определится как:
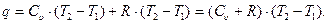
Принимая во внимание то, что 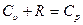 (см. уравнение 4.3), получим:
(см. уравнение 4.3), получим:
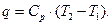 (4.8)
(4.8)
Изотермический процесс (процесс, протекающий при T=const).
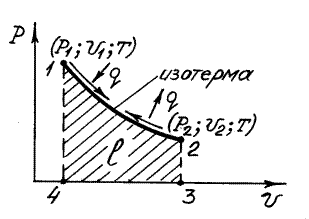 Графическое изображение процесса в P-- координатах показано на рисунке 3
Графическое изображение процесса в P-- координатах показано на рисунке 3
Из характеристических уравнений для начального и конечного состояний газа:
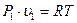 и
и 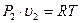 следует, что
следует, что
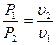 (4.9)
(4.9)
Работа, совершенная газом в изотермическом процессе, находится из уравнения (25):
Рисунок 3
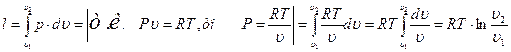 (4.10)
(4.10)
и определяется заштрихованной площадью 1-2-3-4-1, расположенной под линией процесса.
Принимая во внимание то, что при изотермическом процессе 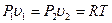 можно получить следующие варианты уравнения (4.11):
можно получить следующие варианты уравнения (4.11):
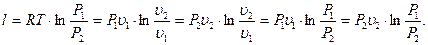 (4.11)
(4.11)
Так как при изотерическом процессе T1=T2 = const, то в соответствии с уравнением (4.8) ∆u=0.
Теплота, необходимая для осуществления изотермического процесса, в соответствии с уравнением (27) и с учётом того, что ∆u=0, определяется как:
q=l. (4.12)
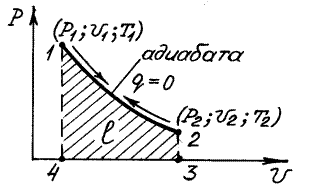
Адиабатный процесс (процесс, протекающий без теплообмена с окружающей средой, т.е соответствующий условию dq=0).
Для адиабатного процесса уравнение первого закона термодинамики (см. уравнение 4.3) приобретает вид:
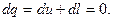 (4.13)
(4.13)
Исследуя уравнение (44) можно установить, что в адиабатном процессе идеального газа между давлением P и удельным объемом 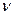 существует следующая зависимость:
существует следующая зависимость:
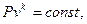 (4.14)
(4.14)
где 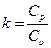 - показатель адиабаты (для всех случаев k>1, так как Cp> Cυ).
- показатель адиабаты (для всех случаев k>1, так как Cp> Cυ).
В P-υ координатах этот процесс изображается кривой – неравнобокой гиперболой, проходящей более круто, чем изотерма, так как 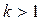 (см. рис. 4).
(см. рис. 4).

Из характеристических уравнений для начального и конечного состояний газа, записанных с учётом уравнения (4.15):
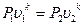 ,
,
можно получить соотношение между параметрами:
|
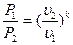 и
и 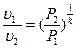 , (4.16)
, (4.16)
а после несложных преобразований:
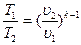 и
и 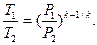 (4.17)
(4.17)
В результате интегрирования уравнения (25) с учётом уравнения (4.15) и соотношений параметров, установленных в адиабатном процессе, могут быть получены зависимости для определения работы, совершаемой газом:


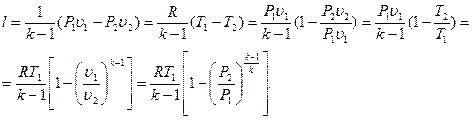 (4.18)
(4.18)
Из уравнения (44) следует, что dl=- du и, соответственно:
l= u1-u2, (4.19)
т.е., в связи с тем, что в адиабатном процессе внешняя теплота не участвует, то работа расширения совершается за счёт уменьшения внутренней энергии газа, что приводит к понижению его температуры. С другой стороны, работа, затрачиваемая на сжатие газа, полностью идёт на увеличение его внутренней энергии, в результате чего температура газа повышается.
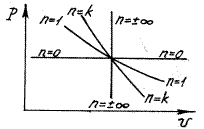
Политропный процесс. Рассмотренные выше четыре процесса (изохорный, изобарный, изотермический и адиабатный) имели ярко выраженные характерные условия протекания. Однако, наряду с этими «основными» процессами возможны процессы, протекающие в промежуточных областях. Такие процессы называют политропными.
Уравнение политропного процесса имеет вид:
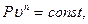 (4.20)
(4.20)
 где n – показатель политропны, являющийся для каждого конкретного процесса величиной постоянной (он может принимать значения в пределах от +∞ до -∞).
где n – показатель политропны, являющийся для каждого конкретного процесса величиной постоянной (он может принимать значения в пределах от +∞ до -∞).
Рассмотренные выше «основные» термодинамические процессы являются частными случаями политропного процесса. Действительно, полагая в уравнении (4.20) n=0, получим изобарный процесс; если n=1 – изотермический процесс; при n=k – адиабатный Рисунок 5процесс; при n=±∞ - изохорный процесс.
Изображение политропных процессов в P - υ - координатах представлено на рисунке 5.
Формулы для определения работы в политропном процессе и формулы, устанавливающие связь между параметрами, аналогичны таковым в адиабатном процессе, так как уравнения этих процессов совершенно одинаковы по форме и различаются только по буквенным обозначениям показателя степени у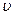 .
.
Количество теплоты, участвующей в политропном процессе определяется по известной уже формуле:
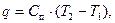 (4.21)
(4.21)
где Сп – теплоемкость газа в политропном процессе, рассчитываемая по уравнению:
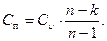 (4.22)
(4.22)
Как было показано, при изучении термодинамических процессов используется уравнение состояния газа 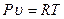 и математическое выражение первого закона термодинамики
и математическое выражение первого закона термодинамики 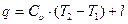 , которые в зависимости от характера и условий протекания процесса приобретают тот или иной частный вид. Кроме того, наряду с графическим изображением в
, которые в зависимости от характера и условий протекания процесса приобретают тот или иной частный вид. Кроме того, наряду с графическим изображением в 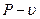 - координатах, при изучении термодинамических процессов пользуются их изображением и в T-S- координатах.
- координатах, при изучении термодинамических процессов пользуются их изображением и в T-S- координатах.
Тема лекции 5 Основные показатели работы тепловых установок. Закон сохранения массы и закон сохранения энергии. Основные законы, характеризующие работу тепловых установок. Тепловой баланс.
Все материалы, подвергаемые тепловой обработке в производстве строительных изделий, представляют собой неоднородные (гетерогенные) системы, в которых совмещаются три фазы агрегатного состояния. Твердую фазу представляет скелет материала, жидкую - влага и газообразную —воздух, пары воды и газы.
Основные законы, характеризующих работу тепловых установок.
Тепловым процессом называют закономерную совокупность стадии теплового воздействия на материал (исходное сырье) с целью придания ему определенных заданных заранее свойств. Теловые процессы протекают в специальнных устройствах, называемых тепловыми установками. Главным признаком тепловой установки - использование подданной тепловой энергии для технологической переработки материала или для ускорения протекающих при переработке химических реакций. В тепловой установке происходит теплообмен между рабочим телом – теплоносителем, и материалом непосредственно, либо через промежуточную стенку.
По организационно-технической структуре тепловые процессы условно делят на непрерывные и периодические, хотя оба они осуществляются непрерывно. В непрерывных процессах все стадии тепловой обработки проходят одновременно, но в разных точках установок. В периодических процессах отдельные стадии тепловой обработке протекают по всей установке, но в разное время. Периодические работают по замкнутому циклу. Сначала загружают рабочую камеру материалом. Затем проводят тепловую обработку, после чего материал выгружают. Тепловой режим периодически действующих установок не стационарный. Ибо в каждой пространственной точке рабочей камеры температура изменяется во времени. Установки непрерывного действия работают в режиме, приблежающемся к стационнарному, который с достаточной для практичностью и называют таким.
Конечной стадией тепловых процессов является их расчет. Расчет определяет оптимальные условия введения процесса, потоки перерабатываемых материалов, энергетические затраты, необходимое для осуществления процессов, устанавливает основные габариты установок.Для определния оптимальных условий ведения процесса его анализ начинают с рассмотрения кинетических закономерности. Любые процессы протекают только под действием градиента потенциала переноса ∆D (движущая сила процесса). Как известно, для тепловых процессов эта движщая сила представлена градиентом температуры, для гидродинамических – градиентом давления и т.д.
Основной закон переноса для технологических процессов может быть сформулирован в таком виде: скорость процесса пропорциональна действующей силе ∆D и обратно пропорционально сопративлению R. Под скорость процесса понимают массу материала Gm, прошедшую через поперечное сечение установки F в еденицу времени τ, (Gm / Fτ)
Тогда основной закон переноса может быть записа в виде
Gm / Fτ=∆D/ R=К∆D (5.1)
где К – коэффициент скорости процесса (коэффициент теплоперадачи, коэффициент теплоотдачи и т.д.).
Этот коэффициент отражает влияние всех факторов, не учтенными велечинами, входящими в уравнение.
Из соотношения следует, что движущая силаи коэффициент скорости процесса являются основными для определения размеров установок. Например, задаваясь скоростью процесса из условий работы анологичных установок в промышленности и зная необходимую массу перерабатываемого материала, можно определить площадь поперечного сечения установки:
F= Gm / К τ ∆D (5.2)
Или, зная время пребывания материала в установке τ, площадь поперечного сечения установки F и коэффициент заполнения установки материалом К3 , можно определить необходимый обьем тепловой установки Vy:
Vy= К3 F (5.3)
Подставив значения F, получим
Vy=К3 Gm / К τ ∆D (5.4)
Таким образом, анализ кинетической закономерностей процесса дает возможность, если известна или задана скорость, определятьнеобходимый обьем установки, а также решать обратную задачу – при известном обьеме устанавливать скорость процесса.
Закон сохранения массы и энергии. Тепловые процессы в технологии строительных материалов и изделии связаны с затратой различных видов энергии. По закону сохранения энергии количество энергии, введенной в процесс, равно количеству, полученному в результате процесса.
Закон сохранения энергии формулируется так: в замкнутой системе сумма всех видов энергии постоянна; энергия не может ни исчезнуть бесследно, ни возникнуть из ничего; она может только перейти в строго эквивалентное количество другого вида энергии. Так как теплота представляет собой один из видов энергии, то в случае, если она в данном аппарате не превращается в другой вид энергии, этот закон может быть сформулирован следующим образом: приход теплоты в данном цикле производства должен быть точно равен расходу ее в этом же цикле. При этом должно быть учтено теплосодержание каждого компонента, как входящего, так и выходящего из процесса или аппарата, а также теплообмен с окружающей средой.
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции. С точки зрения атомно-молекулярного учения этот закон объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит лишь их перегруппировка. Закон сохранения массы веществ является основным законом химии, все расчёты по химическим реакциям производятся на его основе. Именно с открытием этого закона связывают возникновением современной химии как точной науки.
С законом сохранения массы веществ тесно связан закон сохранения энергии: энергия не возникает из ничего и не исчезает бесследно, но одни её виды могут превращаться в другие в строго эквивалентных количествах.
Так при разложении воды, кислот, щелочей или солей посредством электрического тока электрическая энергия превращается в химическую. То же наблюдается при зарядке аккумулятора. Обратный процесс — превращение химической энергии в электрическую — происходит при разрядке аккумулятора.
Альберт Эйнштейнпоказал, что между массой тела и его энергией Е существует связь, выражаемая соотношением:
E = mc2, (5.5)
где с - скорость света в вакууме, равная 300 000 км/с.
Это уравнение применимо ко всем энергетическим процессам; в том числе к химическим и ядерным реакциям. Из него следует, что если масса системы изменяется, то происходит изменение и её энергии, и наоборот: изменение внутренней энергии системы всегда сопровождается изменением массы. Вследствие химических реакций всегда выделяется или поглощается энергия. Поэтому строго говоря, масса веществ, участвующих в этих реакциях, должна изменяться: при выделении теплоты — уменьшаться, а при поглощении — увеличиваться. Однако вследствие очень большой величины множителя с2 изменения массы при химических реакциях настолько малы, что определить их существующими методами невозможно.
Рассчитаем, например, какому количеству энергии соответствует изменение массы на 1 г:
Е = 1·10-3·(3·108)2 = 9·1013 Дж.
При образовании 1 моля воды из газообразных водорода и кислорода выделяется 285,9 кДж энергии, то уменьшение массы составит 3,2·10-9 г. Эта величина далеко за пределами возможностей взвешивания. Тепловые эффекты химических реакций таковы по своей величине, что изменение массы веществ в их результате не могут быть изменены. Поэтому закон сохранения массы веществ не могут быть измерены. Поэтому закон сохранения массы веществ соблюдается практически при всех химических реакциях.
 2014-02-24
2014-02-24 7078
7078
