Правило Морковникова
Химические свойства алкенов.
Применение алканов
Лабораторные способы
Промышленные
Способы получения алканов
1)При нагревание углерода в атмосфере водорода
С+2Н2 = СН4
2)Взаимодействие оксида углерода с водородом
СО + Н2 = СnH2n+2+ H2O
3)Крекинг –процесс разрыва связей С-С, который протекает при нагревание органического вещества и в присутствие катализатора.
СН3-СН2-СН2-СН2-СН2-СН3 = СН3-СН2-СН3 + СН2=СН-СН3
1)Реакция Вюрца
2 СН3Сl +2Nа = CH3- CH3 +2NaCl
Алканы используют в качестве топлива: бытового, промышленного, для двигателя внутреннего сгорания и длительных двигателей
Алкены
Общая формула СnH2n
Алкенами называют непредельные углеводороды с открытыми углеродными цепями, молекулы которых содержат одну двойную углерод - углеродную связь.
Простейшим представителем алкенов является этилен
Для алкенов характерно три типа изомерии:
-изомерия углеродного скелета
-изомерия положения двойной связи
-геометрическая изомерия
Для алкенов характерна sp2- гибридизация. Гибридизации подвержены одна s и две р-орбитали.
При параллельном расположение осей р-орбиталей двух атомов происходит их боковое перекрывание с образованием π- связи. π-связь менее прочная и более доступная доступная для атаки реагентов, чем σ- связь.
Номенклатура алкенов
1)Самая длинная цепь должна содержать двойную связь.
2)Цепь нумеруют с того конца где ближе двойная связь.
3)В основе названия суффикс ан меняем на ен
Наличие в молекуле двойной связи обуславливает характерные свойства реакции при соединении окисления и полимеризации.
1)Гидрирование – присоединение водорода по месту двойной связи
СН2=СН-СН3+H2 = СН3-СН2-СН3
2) Галогенирование- присоединение молекул хлора или брома по месту разрыва двойной связи
СН2=СН2 +Br2 = CН2Br-СН2Br 1,2 –дибромэтан
3)Гидрогалогенирование – присоединение галогенводородов по месту разрыва двойной связи
СН2=СН2 +HСl = СН3-СН2Сl
Пример СН2=СН-СН3 + НВr = СН3 - СНВr-СН3
4)Гидратация - взаимодействие алкенов с водой с образованием спиртов
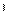
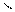
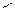
 СН2=СН-СН2-СН3+Н2О СН3-СН-СН2-СН3
СН2=СН-СН2-СН3+Н2О СН3-СН-СН2-СН3
ОН
3) Реакция окисления(горения)
С3Н4+3О2=2СО2+2Н2О
4)Качественная реакция на двойную связь (пропускание алкена через водный раствор перманганата калия,происходит обесцвечивание)
СН2=СН2 + [О] +Н2О = НОСН2-СН2ОН 1,2 - этандиол
Способы получениям
Промышленные способы получения алкенов
1. Основным промышленным источником алкенов служит крекинг алканов, входящих в состав нефти:
| t | ||
| С8Н18 | → | С4Н10 + С4Н8 |
Крекинг протекает по свободнорадикальному механизму при высоких температурах (400-700 °С).
2. Дегидрирование алканов:
| t, Cr2O3 | ||
| СН3-СН2-СН3 | → | СН3-СН=СН2 + Н2 |
| Лабораторные |
1) Дегидратация спиртов происходит при их нагревании с водоотнимающими средствами, например с серной кислотой при температуре выше 150 °С:
| H2SO4 | ||
| СН3-СН2-ОН | → | СН2=СН2 + Н2О |
2) Отщепление галогеноводородов проводят при действии спиртовых растворов щелочей на моноалкилгалогениды:
| С2Н6ОН | ||
| СН3-СН2-СНВr-СН3 + КОН | → | СН3-СН=СН-СН3 + КВr + Н2О |
Диеновые углеводороды.
Алкадиенами(или диеновыми) называют углеводороды с открытыми углеродными цепями,в молекулах которых содержатся две двойные связи. Общая формула алкадиенов:СnH2n-2
Если двойные связи разделены в углеродной цепи двумя или более одинарными связями, их называют изолированными:
СН2=СН-СН2-СН=СН2
пентадиен-1,4
Если две двойные связи располагаются при одном атоме углерода, их называют кумулированными: СН2=С=СН2
Если двойные связи разделены в молекуле одной сигма-связью, их называют сопряженными: СН2=СН-СН=СН-СН3
Химические свойства
1)галогенированние
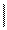
 СН2Br-СНBr-СН=СН2
СН2Br-СНBr-СН=СН2
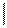 СН2=СН-СН=СН2+Br2-
СН2=СН-СН=СН2+Br2-
 СН2Br-СН=СН-СН2Br2
СН2Br-СН=СН-СН2Br2
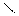 2)полимеризация
2)полимеризация
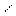
 nСН2=СН-СН=СН2 (-СН2-СН=СН-СН2)n
nСН2=СН-СН=СН2 (-СН2-СН=СН-СН2)n
Способы получения
1)Дегидрирование алканов
| t,Сr2О3 | ||
| СН3-СН2-СН2-СН3 | → | СН2=СН-СН=СН2 + 2Н2, |
а изопрен (2-метилбутадиен-1,3) — из 2-метилбутана:
2) реакция Лебедева путем одновременного дегидрирования и дегидратации этанола:
| t, ZnO, Al2O3 | ||
| 2С2Н5ОН | → | СН2=СН-СН=СН2 + Н2 + 2Н2О. |
Алкины
Алкинами- называют углеводороды с открытыми углеродными цепями, содержащие в молекуле одну тройную углерод-углеродную связь.
СnН2n-2
Алкины- sp - гибридизация
Для алкинов характерно изомерия углеродного скелета, положения кратной связи.
Номенклатура
1 Выбираем самую длинную цепочку;
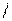
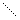
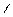
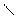 2 нумеруем где ближе 3 связь;
2 нумеруем где ближе 3 связь;
3 основа алкана.только меняем суффикс ан на ин.
СН3-СН2≡СН2-СН2--СН3
Химические свойства.
Для алкинов характерна реакция присоединения,замещения.
1.Галогенирование

 НС≡СН+Br2 BrНС=СНBr Br2НС-СНBr2
НС≡СН+Br2 BrНС=СНBr Br2НС-СНBr2
2.Гидрирование
tо,Ni tо,Ni

 НС
НС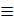 С-СН3+Н2 СН2=СН-СН3+Н2 СН3-СН2-СН3
С-СН3+Н2 СН2=СН-СН3+Н2 СН3-СН2-СН3
пропин
3.Гидрогалогинирование
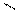
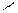
 НС≡СН+НСl СН2=СНСl
НС≡СН+НСl СН2=СНСl
4.Гидратация
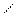
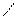 О
О
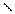
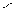

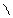 НС≡СН+Н2О СН3-С
НС≡СН+Н2О СН3-С
Н
В результате гидратации образуются альдегиды.
5.Горения
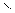
 2НС≡СН+5О2 4СО2+2Н2О
2НС≡СН+5О2 4СО2+2Н2О
6.Окисление
 НС≡СН+ 4 [О] НООС-СООН
НС≡СН+ 4 [О] НООС-СООН
щавелевая кислота
7.Кислотные свойства(реакция замещения)
а)взаимодействие с натрием
 НС≡СН + 2Na Na-С≡С-Na + Н2
НС≡СН + 2Na Na-С≡С-Na + Н2
б)взаимодействие с оксидом серебра
 НС≡СН + Ag2O Ag-C≡C- Ag + Н2О
НС≡СН + Ag2O Ag-C≡C- Ag + Н2О
Применение (алкенов)-этин широко применяют в органическом синтезе он является одним из исходных веществ в производстве синтетических каучуков, так же применяют в сварке.
Способы получения
1.Пиролиз метана при температуре 15000С
 2СН4 НС≡СН+3Н2
2СН4 НС≡СН+3Н2
2.Разложение карбида кальция
 СаС2+2Н2О НС≡СН + Са(ОН)2
СаС2+2Н2О НС≡СН + Са(ОН)2
3.Дегидрогалогенирование
 СН2Br-СНBr-СН3 + 2КОН НС≡С-СН3 +2КBr+ 2Н2О
СН2Br-СНBr-СН3 + 2КОН НС≡С-СН3 +2КBr+ 2Н2О
Ароматические углеводороды (Арены)
Ароматические углеводороды – это углеводороды которые содержат бензольное кольцо
В 1865г. Кекуле предложил структурную формулу бензола, представляющая собой цикл из шести углеродных атомов с чередующимися одинарными и двойными связями.
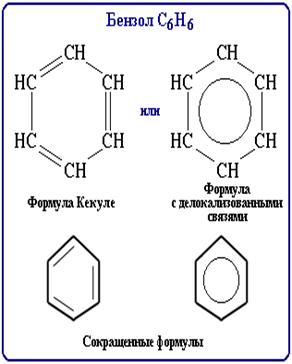
Для бензола характерна sp2 гибридизация
Изомерия связана со строением заместителей и их расположение в бензольном кольце.
Номенклатура
1)В основе названия аренов –бензол
2)Расположение заместителей обозначают терминами
0рто(о) – 1,2 положение
мета(м)-1,3 положение
Пара(п)-1,4 положение
Химические свойства аренов
Реакции замещения
1. Галогенирование.
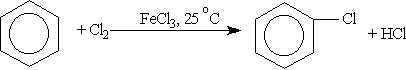
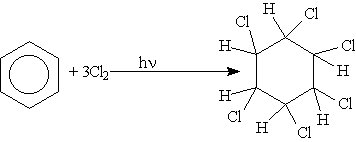
Радикальное галогенирование. Взаимодействие паров бензола с хлором протекает по радикальному механизму только под воздействием жесткого ультрафиолетового излучения. При этом бензол присоединяет три молекулы хлора и образует твердый продукт — гексахлорциклогексан (гексахлоран) С6Н6Сl6:
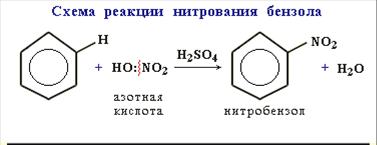
2. Нитрование. Бензол очень медленно реагирует с концентрированной азотной кислотой даже при сильном нагревании. Однако при действии так называемой нитрующей смеси (смесь концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:
3. Гидрирование. Реакция присоединения водорода к аренам идет при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd). Бензол превращается в циклогексан, а гомологи бензола — в производные циклогексана:
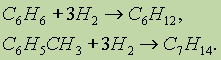
 2014-02-24
2014-02-24 2111
2111
