Лимитирующая стадия. Способы определения лимитирующей стадии
Гетерогенные некаталитические процессы
ПЛАН ЛЕКЦИИ
Лекция 7
Производительность единицы объема реактора по целевому продукту
Оптимальный температурный режим обеспечивает максимальную
Изменении температуры на входе на 1 градус
Как изменяется температура на выходе из реактора при
Параметрическая тепловая чувствительность показывает
Определяется ее реакцией на возмущающие воздействия
Устойчивость системы в стационарном состоянии
ВЫВОДЫ
Большинство химических реакций, используемых в химико-технологических процессах, протекает с участием веществ находящихся в разных фазах.
Особенностью гетерогенных процессов является наличие наряду с химическими стадиями также физических стадий.
Гетерогенные процессы протекают на поверхности раздела фаз.
Если сложный процесс состоит из нескольких стадий, его скорость равна сумме скоростей этих стадий.
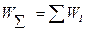 |
Скорость всего процесса определяется скоростью самой медленной стадии, которая называется лимитирующей стадией.
|
|
|
Скорость сложного гетерогенного процесса зависит от скоростей химической реакции и скоростей диффузионных стадий.
Скорость диффузии зависит от плотности и вязкости среды, температуры, природы диффундирующих частиц, воздействия внешних сил и т. д. Закономерности диффузионных процессов описываются законами Фика.
Согласно первому закону Фика количество вещества А, перенесенного вследствие диффузии в единицу времени через поверхность S, перпендикулярную направлению переноса, пропорционально градиенту концентрации этого вещества в данный момент времени:
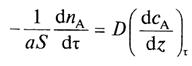 |
(1)
•Коэффициент пропорциональности D называется коэффициентом молекулярной диффузии;
•Изменение концентрации вещества А во времени в результате молекулярной диффузии описывается вторым законом Фика
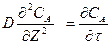 |
(2)
или для диффузии в трехмерном пространстве
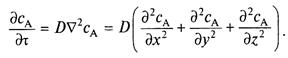 (3)
(3)
Заменив в (1) градиент концентрации на отношение конечных приращений получим:
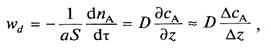 (4)
(4)
где DСА — изменение концентрации на расстоянии DZ =d — толщина слоя, через который проходит диффузионный поток.
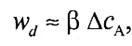 |
Тогда (5)
где b — коэффициент пропорциональности (коэффициент массоотдачи),
(6)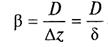
Коэффициент молекулярной диффузии D (коэффициент пропорциональности в уравнениях скорости диффузии) является функцией молекулярных свойств того вещества, которое диффундирует, и того вещества, в котором происходит диффузия первого. Он слабо возрастает с ростом температуры (~Т— T3/2) и уменьшается с ростом давления. Чаще всего коэффициент D определяют по опытным данным, а также по эмпирическим или полуэмпирическим зависимостям.
|
|
|
Кинетические модели гетерогенных процессов в системе «газ- твердое вещество».
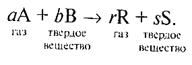 |
Для гетерогенной реакции
Существуют две модели: Квазигомогенная модель и модель с фронтальным перемещением зоны реакции.
Квазигомогенная модель предполагает, что гетерогенный процесс протекает одновременно в любой точке объема твердой частицы. Это возможно, если газообразный реагент может достаточно свободно проникнуть внутрь твердой фазы, т. е. если частица твердого вещества пронизана большим числом пор, а химическая реакция, протекающая на поверхности этих пор, достаточно медленная.
• Модель с фронтальным перемещением зоны реакции. Согласно этой модели химическая реакция сначала протекает на внешней поверхности частицы, и до тех пор, пока внешний слой твердого реагента полностью не превратится в соответствующие твердые или газообразные продукты реакции, более глубинные слои в реакцию не вступают. Постепенно зона химической реакции продвигается внутрь, оставляя за собой твердый продукт реакции и инертную часть исходного твердого реагента (золу). В произвольный момент времени твердая частица представляет собой внутреннее ядро, окруженное внешней оболочкой. Ядро состоит из непрореагировавшего реагента (поэтому эту модель называют иногда моделью с непрореагировавшим ядром).
Гетерогенный процесс, описываемый моделью с фронтальным перемещением зоны реакции, можно разделить на пять основных стадий:
1. Внешняя диффузия — подвод реагента А к поверхности твердой частицы через слой газа, обедненный этим компонентом;
2. Внутренняя диффузия — проникновение газообразного реагента через поры твердого продукта реакции к ядру твердого реагента;
3. Химическая реакция на поверхности непрореагировавшего ядра;
4. Внутренняя диффузия газообразных продуктов через слой твердых продуктов;
5. Внешняя диффузия газообразных продуктов в ядро газового потока.
Внешняя диффузия. В результате протекания химической реакции
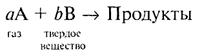 |
Концентрация газообразного реагента А у поверхности твердой частицы ниже, чем в ядре газового потока
Суммарный перенос вещества вследствие молекулярной диффузии и конвективного переноса называется конвективной диффузией.
Процесс конвективной диффузии может быть описан дифференциальным уравнением
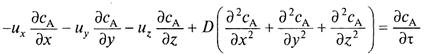 (7)
(7)
или в более краткой записи:
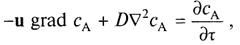 (8)
(8)
Где ux, uY, uZ— линейные скорости потока в направлении осей соответственно х, у, z.
Для определения скорости конвективной диффузии пользуются уравнением
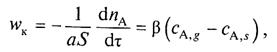 |
(9)
где Wk— скорость конвективной диффузии, т. е. количество газообразного реагента А, перенесенное вследствие конвективной диффузии через единицу поверхности в единицу времени; (— коэффициент массоотдачи, зависящий от гидродинамики потока.
Принимают, что у поверхности твердой частицы существует неподвижный диффузионный подслой толщиной, внутри которого перенос вещества осуществляется исключительно вследствие молекулярной диффузии. Скорость внешней диффузии (конвективной) через реальную газовую пленку толщиной можно приравнять тогда скорости молекулярной диффузии через диффузионный подслой толщиной 1. В соответствии с уравнением
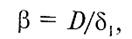 |
(10)
где D — коэффициент молекулярной диффузии.
Внутренняя диффузия. Если в результате гетерогенного взаимодействия газообразного и твердого реагентов наряду с газообразными образуются и твердые продукты реакции, стадией, предшествующей собственно химической реакции и следующей за внешней диффузией, будет стадия внутренней диффузии — проникновения газообразного реагента через слой твердых продуктов реакции к поверхности ядра, на которой осуществляется химическое взаимодействие.
|
|
|
Скорость внутренней диффузии
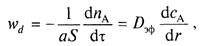 (11)
(11)
где Dэф — эффективный коэффициент диффузии, учитывающий пористость твердого вещества, извилистость пор и т. д.
Если толщина слоя золы невелика, можно считать, что
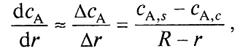 |
(12)
где R — внешний радиус твердой частицы — постоянная величина в рамках рассматриваемого случая частицы с неизменяющимися внешними размерами; r — радиус ядра, уменьшающийся по мере протекания процесса.
Тогда скорость внутренней диффузии можно представить в виде уравнения
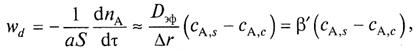 |
(13)
Поверхностная химическая реакция.
Скорость поверхностной реакции может быть описана законами химической кинетики
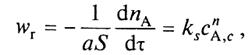 |
(14)
где ks — константа скорости поверхностной химической реакции;
п — порядок реакции.
 2014-02-09
2014-02-09 3074
3074
