Температура кипения раствора.
Относительное понижение давления насыщенного пара над раствором равно мольной доле растворенного вещества.
Свойства растворов рассматривают на примере разбавленных растворов, при образовании которых тепловой и объемный эффекты равны 0 (идеальные растворы). В таких растворах частица находятся на большом расстоянии друг от друга и силами взаимного влияния можно пренебречь.
Понижение давления пара вызвано тем, что поверхность раствора, в отличие от поверхности растворителя частично занято частицами нелетучего растворенного вещества. Это приводит к уменьшению числа молекул растворителя, испаряющихся в единицу времени; число же молекул растворителя, переходящего из газа в раствор, остается без изменения. Однако основную роль играют силы сольватационного взаимодействия. Они значительно прочнее сил сцепления между молекулами растворителя, чем и объясняется переход меньшего числа молекул растворителя в газовую фазу.
Рассмотрим двухкомпонентный идеальный раствор. Пусть давление насыщенного пара растворителя и растворенного вещества: Р01 и Р02 соответственно. Мольные доли: Х1 и Х2. Если растворенное вещество является нелетучим, то Р02=0. Тогда общее давление пара равно парциальному давлению пара растворителя: Р=Р1= Р01*Х1. Общее давление насыщенного пара раствора определяется только парциальным давлением пара летучего компонента.
т. е. давление насыщенного пара растворителя над раствором равно произведению его давления над чистым растворителем на мольную долю растворителя (первый закон Рауля, 1887 г.).
Уравнению (2.55) можно придать несколько иной вид. Так как хI = 1 – х2 (где х2 - мольная доля растворенного вещества), то
р1= р01(1-х2)= р01–р01х2 или р01–р1= р01х2
р01–р1/ р01= х2
Любая жидкость начинает кипеть при температуре, при которой давление ее насыщенного пара достигает величины внешнего давления. Т кип – Т, при которой давление пара= 101,3 кПа.Вода кипит при 100 С, т.к. давление в этой точке на фазовой диаграмме равно 1 атм. По закону Рауля если ввести в р-р нелетучий компонент давление пара понизится. Теперь уже надо нагреть р-р выше 100 с, чтобы довести давление до 1 атм.
Т зам – Т, при которой давление пара вода = давлении е пара льда = 613 Па.
Р-р, содержащий нелетучее вещество обладает меньшей летучестью, чем чистый растворитель. Поэтому его кипение начинается при более высокой Т, чем кипение чистого растворителя.
DТ=Тр-р–Тр-ль=Есm, сm–моляльность растворенного вещества, Е –эбулиоскопическая постоянная р-ля.
Дать диаграмму.
Кристаллы растворителя будут находиться в равновесии с раствором только тогда, когда давление насыщенного пара над кристаллами и над раствором одинаково. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, температура, отвечающая этому условию, всегда будет более низкой, чем температура замерзания чистого растворителя. При этом понижение температуры замерзания раствора ΔTзам не зависит от природы растворенного вещества и определяется лишь соотношением числа частиц растворителя и растворенного вещества.
Можно показать, что понижение температуры замерзания раствора ΔTзам прямо пропорционально моляльной концентрации раствора:
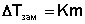
Второй закон Рауля: Повышение Ткип и понижение Тзам р-ра пропорциональны числу частиц растворенного вещества и не зависят от его природы.
 2014-02-09
2014-02-09 1418
1418
