Стадии существования экспертных систем
Стадия существования характеризует степень проработанности и отлаженности экспертной системы. Обычно выделяют следующие стадии:
- исследовательский прототип;
- действующий прототип;
- промышленная система;
- коммерческая система.
Исследовательским прототипом называют систему, которая решает представительный класс задач приложения, но может быть неустойчива в работе и не полностью проверена. При наличии развитых инструментальных средств для разработки исследовательского прототипа требуется примерно 2-4 месяца. Исследовательский прототип обычно имеет в базе знаний не больше 50 исполняемых утверждений; при использовании только частных утверждений их количество возрастает в 3-10 раз.
Действующий прототип надежно решает все задачи, но для решения сложных задач может требовать чрезмерно много времени и (или) памяти. Доведение системы от начала разработки до стадии действующего прототипа требует примерно 6-9 месяцев, при этом количество исполняемых утверждений в базе знаний увеличивается до 100.
Экспертная система, достигшая стадии промышленной системы, обеспечивает высокое качество решений всех задач при минимуме времени и памяти. Обычно процесс преобразования действующего прототипа в промышленную систему состоит в расширении базы знаний (до 150 исполняемых утверждений) и ее тщательной отладки. Доведение экспертной системы от начала разработки до стадии промышленной системы на развитых инструментальных средствах требует примерно 12-18 месяцев.
Обобщение задач, решаемых экспертной системой на стадии промышленной системы, позволяет перейти к стадии коммерческой системы, то есть к системе, пригодной не только для собственного использования, но и для продажи различным потребителям. Доведение системы до коммерческой стадии требует примерно 1.5-2 года. Приведенные выше сроки справедливы для экспертных систем средней сложности.
Атмосферный озон является одним из самых важных газов Земной атмосферы. С одной стороны, озон защищает жизнь на Земле, поглощая большую часть жесткого ультрафиолетового излучения Солнца, с другой стороны, по своим химическим свойствам озон является сильным окислителем и токсичным газом, и его чрезмерное содержание в нижней части атмосферы является вредным для человека, животных и растений. Таким образом, с одной стороны, количество озона в атмосфере должно быть достаточным для защиты жизни на Земле от повышенного уровня ультрафиолетовой радиации, а с другой стороны, его содержание в приземном слое не должно превышать определенный уровень, чтобы избежать токсичных воздействий на флору и фауну. Кроме того озон, благодаря своим радиационным свойствам, оказывает существенное влияние на климат Земли, внося свой вклад в нагрев атмосферы за счет поглощения солнечной радиации и в охлаждение за счет собственного излучения тепловой энергии.
Эволюция атмосферы привела к оптимальному высотному распределению озона. Большая его часть (около 90 %) находится на высотах 15-50 км, в стратосфере, не представляя контактной опасности для людей. В нижней части атмосферы, в тропосфере (0-12 км), концентрация озона почти в 100 раз меньше чем в стратосфере. Таким образом, стратосферный озон играет роль защитного экрана для солнечного ультрафиолетового излучения, не представляя контактной опасности для человека, в то время как тропосферный озон не вносит сколь либо существенного вклада в ослабление солнечной ультрафиолетовой радиации, а его повышенные концентрации могут быть опасными для биосферы. Тем самым, экологическая проблема атмосферного озона заключается в недопущении его уменьшения в стратосфере, в одной стороны, и в препятствовании его увеличению в тропосфере, с другой стороны.
Наблюдаемое относительно стабильное содержание озона в атмосфере является результатом равновесия между протекающими совместно и взаимосвязанными химическими, динамическими и радиационными процессами его разрушения и образования. В этой связи, если по каким-либо причинам точка равновесия сдвинется в сторону уменьшения озона, то его содержание в земной атмосфере быстро сократится, что приведет к увеличению потока солнечного ультрафиолетового излучения достигающего земной поверхности, что, в свою очередь, губительно скажется на биосфере.
Результаты наблюдений за содержанием атмосферного озона в течение двух последних десятилетий обнаружили тревожные тенденции его изменчивости в направлении ухудшения обоих направлений связанной с ним экологической ситуации, т.е. уменьшения содержания озона в стратосфере и его увеличения в тропосфере. Начиная в середины восьмидесятых годов, в весенние месяцы над Антарктидой регулярно отмечается уменьшение стратосферного озона более чем в два раза, явление, которое получило название "озоновых дыр". Похожие явления, правда, меньшие по масштабу, в последние годы периодически наблюдаются в Арктике и даже в средних широтах, в частности над территорией Восточной Сибири и Северной Европы. Кроме того, результаты измерений глобальной озонометрической сети и спутниковые наблюдения отмечают отрицательную долгопериодную тенденцию (тренд) среднегодового стратосферного озона в средних широтах обоих полушарий. С другой стороны, результаты измерений тропосферного озона зафиксировали в последние годы его рост со скоростью до 1 % в год.
Наблюдаемые тревожные тенденции изменчивости озона в земной атмосфере, с одной стороны, потребовали от ученых теоретического объяснения наблюдаемых явлений (диагностическая проблема), а с другой стороны, прогноза изменчивости атмосферного озона в ближайшем и отдаленном будущем, на базе понимания природы наблюдаемых процессов (прогностическая проблема). Для решения этих проблем необходимо использовать как результаты измерений динамических, радиационных и химических параметров атмосферы в течение нескольких десятилетий, так и теоретические представления об особенностях протекания в атмосфере физических и химических процессов, влияющих на пространственно-временное распределение озона и связанных с ним газов.
Долгопериодная изменчивость атмосферного озона может вызываться, как естественной природной изменчивостью, такой как одиннадцатилетний цикл солнечной активности, вулканические выбросы сульфатного аэрозоля, или квазипериодические изменения динамической структуры атмосферы (явления QBO и ENSO), так и антропогенными воздействиями на атмосферу, такими как промышленные выбросы хлорфторуглеводородов (фреонов) и бромсодержащих газов (галонов) в погранслое Земли с последующим переносом в вышележащие слои атмосферы, и самолетные выбросы газов и аэрозоля непосредственно на высотах тропосферы (дозвуковые самолеты) и стратосферы (сверхзвуковые самолеты). Для идентификации причин наблюдаемой изменчивости озона в атмосфере необходимо исследовать как естественные, так и антропогенные факторы.
Значительная степень влияния хозяйственной деятельности человека на атмосферный озон, а также глобальный характер этой проблемы привели к появлению ряда международных соглашений, ограничивающих промышленное использование озоноразрущающих веществ. Тем самым, научное исследование причин наблюдаемой в последнее время изменчивости озона в атмосфере необходимо для принятия решений на политическом уровне, касающихся регулирования выбросов озоноразрушающих веществ в атмосферу и поиска безопасных для озона заменителей озоноразрушающих веществ для использования в промышленном производстве.
Наблюдаемая изменчивость озоносферы стимулировала в последнее десятилетие интенсивное теоретическое и экспериментальное изучение физических и химических процессов, влияющих на особенности пространственно-временного распределения атмосферного озона и влияющих на него газов. Подобные исследования являются особенно важными в связи с тем обстоятельством, что существовавшие на середину 80-х годов теории и модели оказались не в состоянии ни предсказать, ни объяснить неожиданное появление "озоновых дыр". Другим важным обстоятельством, заставившим ученых интенсифицировать исследования процессов в озоносфере, явилось опасение возможностью появления "озоновых дыр" за пределами полярных широт, в густонаселенных районах Земного шара.
ПРОЦЕССЫ, ФОРМИРУЮЩИЕ ФОНОВОЕ РАСПРЕДЕЛЕНИЕ ОЗОНА.
Пространственно-временное распределение озона в атмосфере определяется фотохимическими и динамическими процессами и является функцией высоты, широты и сезона. При описании химических процессов образования и разрушения озона автор учитывал то, что озон входит в семейство нечетного кислорода Ox. Это означает, что если в результате химической реакции образования озона разрушается атомарный или возбужденный кислород, то фактического образования озона не происходит, т.к. количество атомов нечетного кислорода не изменяется из-за того, что обратные реакции возвращают озон в состояние атомарного или возбужденного кислорода.
Атмосферный озон сосредоточен, главным образом, в стратосфере (90 %) и тропосфере (около 10 %) [1-4]. Фактически единственным источником нечетного кислорода в стратосфере является фотодиссоциация молекулярного кислорода в результате поглощения солнечной радиации в полосах Шумана-Рунге (175-195 нм) и континууме Герцберга (195-242 нм) с образованием двух атомов кислорода:
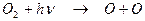 (2.3)
(2.3)
с последующей рекомбинацией с молекулами кислорода в присутствии третьей молекулы:
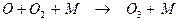 (2.4)
(2.4)
При этом обратная реакция фотодиссоциации озона может быстро вернуть озон в состояние атомарного кислорода:
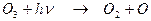 (2.5)
(2.5)
В стратосфере и тропосфере более 99% Ох находится в форме озона [2]. Таким образом, фактическое содержание озона в атмосфере определяется реакцией (2.3), а реакции (2.4)-(2.5) лишь определяют содержание атомарного кислорода.
Разрушение озона в атмосфере происходит при переходе нечетного кислорода в молекулярный кислород. Этот процесс может происходить либо в химической реакции взаимодействия озона с атомарным кислородом
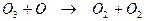 (2.12)
(2.12)
либо в, так называемых [2-4], каталитических циклах типа:
X + O3 -> XO + O2
XO + O -> X + O2
________________________________________
O + O3 -> O2 + O2 (2.13)
где 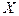 и
и 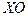 условно обозначают пары атмосферных радикалов водородного, азотного, хлорного и бромного типа. В результате цепочки реакций (2.13) молекулы озона и атомарного кислорода переходят в две молекулы кислорода, а концентрации взаимодействующих с ними веществ
условно обозначают пары атмосферных радикалов водородного, азотного, хлорного и бромного типа. В результате цепочки реакций (2.13) молекулы озона и атомарного кислорода переходят в две молекулы кислорода, а концентрации взаимодействующих с ними веществ 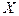 и
и 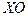 не меняются. Таким образом, после завершения цикла (2.13)
не меняются. Таким образом, после завершения цикла (2.13) 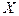 и
и 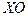 могут вновь разрушать новые молекулы озона. В качестве примеров
могут вновь разрушать новые молекулы озона. В качестве примеров 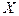 и
и 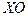 можно привести пары H/OH, OH/HO2, NO/NO2, Cl/ClO, Br/BrO.
можно привести пары H/OH, OH/HO2, NO/NO2, Cl/ClO, Br/BrO.
Повторение цикла будет происходить пока 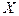 или
или 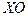 не вступят в химическое взаимодействие с другими газами. Следует заметить, что циклы разрушения озона могут состоять не только из двух, но и из большего количества реакций в цепочке. Определяющим при составлении каталитического цикла является одинаковое количество участвующих в реакциях и образующихся в результате их одинаковых молекул, за исключением газов, входящих в семейство нечетного кислорода.
не вступят в химическое взаимодействие с другими газами. Следует заметить, что циклы разрушения озона могут состоять не только из двух, но и из большего количества реакций в цепочке. Определяющим при составлении каталитического цикла является одинаковое количество участвующих в реакциях и образующихся в результате их одинаковых молекул, за исключением газов, входящих в семейство нечетного кислорода.
Составление каталитических циклов разрушения нечетного кислорода в атмосфере является трудоемкой задачей, носящей субъективный характер. Для того чтобы избежать произвольности в трактовании необходимости рассмотрения того или иного каталитического цикла, автор включил в AUTOCHEM алгоритм автоматического составления каталитических циклов, вносящих существенный вклад в разрушение озона в атмосфере.
На первом этапе AUTOCHEM, используя в качестве входных параметров данные сборника JPL [76], составляет всевозможные цепочки реакций, удовлетворяющие требованию сохранения газов, вступающих и образующихся в результате цикла реакций, и перехода газов нечетного кислорода в молекулярный кислород. На втором этапе алгоритм производит сравнение скоростей реакций, входящих в каталитические циклы со скоростью реакции прямого разрушения озона (2.12) для различных диапазонов характерных для атмосферы температур, влажности, потоков солнечной радиации при различных зенитных углах солнца и содержания основных атмосферных газов. На третьем этапе производится выделение каталитических циклов, учет которых необходим для правильного описания процессов разрушения озона в атмосфере.
Помимо объективного рассмотрения всей совокупности важных для озона химических реакций, разработанный алгоритм кардинально упрощает процесс изменения используемой химической схемы и параметров химических реакций, т.к. не требует внесения изменений в программные блоки модели. Процесс изменений, необходимость которого возникает по мере получения новых лабораторных данных о кинетике важных для атмосферы реакций, заключается в изменении параметров и, при необходимости, числа реакций в таблицах 2.2-2.7.
В результате использования разработанного алгоритма AUTOCHEM автор пришел к выводу, что для правильного рассмотрения процессов каталитического разрушения озона в атмосфере Земли, в комплекс моделей газового состава необходимо включить следующие каталитические циклы:
O3 + NO -> O2 + NO2
O + NO2 -> O2 + NO
_____________________________
O3 + O -> O2 + O2 (2.14)
O3 + OH -> O2 + HO2
O + HO2 -> O2 + OH
____________________
O3 + O -> O2 + O2 (2.15)
H + O3 -> OH + O2
OH + O -> O2 + H
---------------------------
O + O3 = O2 + O2 (2.16)
O3 + ClO -> O2 + ClO2
O + ClO2 -> O2 + ClO
_____________________________
O3 + O -> O2 + O2 (2.17)
O3 + BrO -> O2 + BrO2
O + BrO2 -> O2 + BrO
____________________
O3 + O -> O2 + O2 (2.18)
Кроме того, учитывались и каталитические циклы с участием двух молекул озона:
O3 + OH -> O2 + HO2
O3 + HO2 ->2O2 + OH
____________________
O3 + O3 -> O2 + O2 + O2 (2.19)
А также более сложные, многоступенчатые каталитические циклы разрушения озона в атмосфере:
OH + O -> O2 + H
H + O2 +М -> HO2 +М
HO2 + O -> OH + O2
--------------------------
O + O -> O2 (2.10)
BrO + BrO -> Br + Br + O2
Br + O3 -> BrO + O2
Br + O3 -> BrO + O2
-------------------------------
O3 + O3 -> O2 + O2 + O2 (2.21)
Cl + O3 -> ClO + O2
OH + O3 -> HO2 + O2
ClO + HO2 -> O2 + HOCl
HOCl +  -> OH + Cl
-> OH + Cl
--------------------------------
O3 + O3 -> O2 + O2 + O2 (2.22)
Cl + O3 -> ClO + O2
NO + O3 -> NO2 + O2
ClO + NO2 +M -> ClONO2 + M
ClONO2 +  -> Cl + NO3
-> Cl + NO3
NO3 +  -> NO + O2
-> NO + O2
--------------------------------
O3 + O3 -> O2 + O2 + O2 (2.23)
BrO + ClO -> BrCl + O2
BrCl +  -> Br + Cl
-> Br + Cl
Br + O3 -> BrO + O2
Cl + O3 -> ClO + O2
-------------------------------
O3 + O3 -> O2 + O2 + O2 (2.24)
BrO + ClO -> Br + ClOO
ClOO -> Cl + O2
Br + O3 -> BrO + O2
Cl + O3 -> ClO + O2
-------------------------------
O3 + O3 -> O2 + O2 + O2 (2.25)
Br + O3 -> BrO + O2
OH + O3 -> HO2 + O2
BrO + HO2 -> HOBr + O2
HOBr +  -> Br + OH
-> Br + OH
--------------------------------
O3 + O3 -> O2 + O2 + O2 (2.26)
Для учета каталитического разрушения озона в представленных выше циклах необходимо параметризовать скорость разрушения озона в них в терминах химической кинетики по образу формулы (1.10). Сложность здесь заключается в том, что результирующая реакция цикла в реальности впрямую не происходит, поэтому скорость цикла не может быть описана в форме (1.6), как произведение концентраций озона и нечетного кислорода на константу реакции между ними. Вместо этого, в уравнение (1.10) для нечетного кислорода должны входить некие характеристики газов, участвующих в цепочке реакций конкретного цикла.
Для оценивания скорости разрушения нечетного кислорода в каталитических циклах автор использовал концепцию «реакции, определяющей скорость цикла» [92]. Основное положение этой концепции заключается в том, что нет необходимости включать в уравнение (1.10) скоростей всех реакций цикла, т.к. скорость цикла определяется самой медленной из входящих в него реакций. Действительно, как бы быстры не были отдельные реакции конкретного каталитического цикла, его скорость ограничивается самой медленной реакцией.
Следует отметить, что «реакция, определяющая скорость цикла» может меняться для конкретного цикла, как в пространстве, так и во времени. В этой связи, в химическом блоке комплекса моделей автор использовал автоматическое определение скорости реакции, определяющей цикл в каждой точке пространства и времени, путем сравнения скоростей всех реакций, входящих в цикл, и выбора минимальной для данной точки пространства и времени.
В стратосфере доминирующую роль играет разрушение озона в азотных каталитических циклах (около 70%). Однако существенную роль играет и высотное распределение относительной роли различных каталитических циклов. Так азотный цикл преобладает на высотах максимума концентрации озона (20-40 км), а выше доминирующими становятся сначала хлорный и бромный циклы, а еще выше – водородный. Разрушение озона в тропосфере происходит главным образом в водородном каталитическом цикле (2.19). Реакция (1.3) и циклы (1.5), (1.6) здесь несущественны, поскольку из-за большого количества молекулярного кислорода и высокой концентрации воздуха в тропосфере, практически все образующиеся в результате этих реакций атомы кислорода мгновенно переходят обратно в озон посредством реакции (2.4).
Для оценки скоростей каталитического разрушения озона в атмосфере, а также скорости его продукции в тропосфере и нижней стратосфере в терминах уравнений химической кинетики (1.8)-(1.16), необходимо знать значения концентраций тех газов, которые участвуют в этих процессах. Для этого надо решать эволюционные уравнения (1.1)-(1.10) для всех важнейших газов нижней и средней атмосферы с учетом их разделения по временам жизни. По принципу содержания в них основных элементов, влияющие на озон малые газы атмосферы делятся на азотосодержащие, водородосодержашие, хлорсодержащие, бромсодержащие и серосодержащие. Кроме того, в тропосфере и нижней стратосфере важную роль играют углеродосодержащие газы.
Химия азотосодержащих и водородосодержащих газов
Азотосодержащие радикалы (NO и NO2) появляются в стратосфере главным образом в результате реакции возбужденного атомарного кислорода с закисью азота, имеющей естественное земное происхождение:
O(1D) + N2 O -> NO + NO. (2.27)
Возбужденный атомарный кислород образуется в результате фотодиссоциации озона при поглощении солнечной радиации короче 310 нм:
O3 +  -> O2 + O(1D) (2.28)
-> O2 + O(1D) (2.28)
Разрушаются окислы азота при реакции NO2 c гидроксильным радикалом и третьей молекулой образованием азотной кислоты:
NO2 + OH + M -> HNO3 + M, (2.29)
большая часть которой возвращается в азотные радикалы в результате фотодиссоциации
HNO3 +  -> OH + NO2 (2.30)
-> OH + NO2 (2.30)
или при реакции с ОН
HNO3 + OH -> H2O + NO3 (2.31)
с последующей фотодиссоциацией
NO3 +  -> NO2 + O (2.32)
-> NO2 + O (2.32)
NO3 +  -> NO + O2 (2.33)
-> NO + O2 (2.33)
Часть азотной кислоты диффундирует в тропосферу, где быстро вымывается в облаках и осадках.
Гидроксильные радикалы образуются в атмосфере при реакциях возбужденного атомарного кислорода с парами воды:
O(1D) + H2O -> OH + OH (2.34)
молекулярным водородом:
O(1D) + H2 -> H + OH (2.35)
и метаном
O(1D) + CH4 -> OH + CH3 (2.36)
Разрушение гидроксильных радикалов происходит главным образом в их реакциях между собой
OH + HO2 -> H2 O + O (2.37)
OH + OH -> H2 O + O, (1.38)
а в тропосфере и нижней стратосфере и в реакциях с другими компонентами
OH + HNO3 -> H2O + NO3 (2.39)
OH + HO2NO2 -> H2O + O2 + NO2 (2.40)
OH + H2O2 -> H2O + HO2. (2.41)
Следует отметить важную роль так называемых "резервуарных компонент" HNO3, N2O5, H2O2, HO2NO2 и др. в химии озоносферы. Дело в том, что с одной стороны резервуарные компоненты химически менее активны с точки зрения разрушения озона, и, следовательно, переход в них радикалов в результате химических реакций (1.10),
NO2 + NO3 + M -> N2O5 + M (2.42)
HO2 + HO2 -> H2O2 + O2 (2.43)
HO2 + NO2 + M -> HO2NO2 + M (2.44)
ведет к уменьшению скорости разрушения озона, а с другой стороны они являются оптически активными в видимой области спектра компонентами и при наличии солнечного излучения быстро распадаютя, возвращая радикальные компоненты в оборот разрушения озона: (1.11),
N2O5 +  -> NO2 + NO3 (2.45)
-> NO2 + NO3 (2.45)
H2O2 +  -> OH + OH (2.46)
-> OH + OH (2.46)
HO2NO2 +  -> HO2 + NO2. (2.47)
-> HO2 + NO2. (2.47)
Кроме того, резервуарные компоненты могут вступать в химические реакции с другими компонентами, переноситься динамическими движениями, а также вымываться в облаках и осадках, что ведет к необратимому выходу некоторой части радикалов из оборота разрушения атмосферного озона.
В связи с тем, что условия освещенности атмосферы, также как и динамические параметры, сильно меняются в зависимости от широты, высоты и сезона, химические реакции с участием резервуарных компонент в сильной степени зависят от температуры, а условия вымывания зависят от распределения, природы и водности облаков и аэрозоля, химия резервуарных компонент в значительной степени определяет наблюдаемые особенности пространственно-временного распределения озона в атмосфере.
Галогеносодержащие газы земной атмосферы
К галогеносодержащим газам атмосферы относятся хлорсодержащие и бромсодержащие малые составляющие. Характерной особенностью галогеносодержащих газов является доминирование антропогенной составляющей в источниках их появления в атмосфере. Основными поставщиками хлора являются хлорфторуглеводороды, которые часто называются фреонами, а брома – галоны [65].
Интенсификация хозяйственной деятельности человека в последнее время привела к резкому увеличению промышленных выбросов в атмосферу. Для многих малых газовых составляющих атмосферы масштабы подобных выбросов сравнились с их естественной продукцией, а для некоторых намного превзошли ее. К последним относятся и хлорфторуглеводороды, бесконтрольное использование которых в аэрозольных балончиках, при производстве пластмасс и пенопласта, в качестве растворителей, в холодильниках и кондиционерах, привело к существенному увеличению хлорсодержащих компонентов в стратосфере, что представляет угрозу для озонового слоя [5,9,65]. Кроме того, хлорфторуглеводороды являются радиационно-активными газами и, следовательно, могут внести существенный вклад в парниковый эффект.
В этой связи встал вопрос об оценке степени опасности выбросов конкретных хлорфторуглеводородов изменения озонового слоя при различных мощностях выбросов хлорфторуглеводородов и замене хлорсодержащих компонентов в производственном цикле альтернативными веществами, не оказывающими столь опасное воздействие на озоносферу.
Результатом активности ученых разных стран по привлечению внимания к опасности бесконтрольного использования хлорсодержащих компонентов в промышленности стало появление двух международных соглашений: Венской Конвенции и Монреальского Протокола, определяющих порядок сокращения использования основных фреонов в течение ближайших лет [21,22]. В связи с опасностью хлорсодержащих компонентов для озонового слоя и предстоящим уменьшением их применения в промышленном цикле, в настоящее время ведутся интенсивные технические проработки по созданию их заменителей, так называемых альтернативных фреонов, более безопасных для земной атмосферы. При этом, для оценки потенциальной опасности для атмосферы вновь вводимых в производство веществ, необходимы, во-первых, инструмент, позволяющий оценить влияние этих веществ на химические и радиационные процессы в атмосфере и, во-вторых, количественный критерий потенциальной опасности, позволяющий сравнивать различные компоненты.
Основным источником реактивного хлора в стратосфере являются имеющие производственное происхождение фреоны и другие хлорсодержащие компоненты. Вырабатываемые в промышленности хлорсодержащие газы можно подразделить на полностью галогенированные F11 (CFCl3), F12 (CF2Cl2), F113 (C2F2Cl3), F114 (C2Cl2F4), F115 (C2ClF5) и четыреххлористый углерод CCl4, а также частично галогенированные CH3Cl, метилхлорид CH3Cl и F22 (CHF2Cl).
Полностью галогенированные компоненты практически не разрушаются в тропосфере и за счет динамических процессов попадают в стратосферу, где высвобождают хлор при поглощении жесткого УФ солнечного излучения, которое не проникает в тропосферу:
CFCl3 +  -> CFCl2 +Cl l<260nm
-> CFCl2 +Cl l<260nm
CFCl3 +  -> CFCl+2Cl l<210nm
-> CFCl+2Cl l<210nm
CF2Cl2 + ->CF2Cl+Cl l<240nm
->CF2Cl+Cl l<240nm
CF2Cl2 + ->CF2 +2Cl l<220nm
->CF2 +2Cl l<220nm
CCl4 +  ->CCl3 +Cl l<275nm
->CCl3 +Cl l<275nm
CCl4 + ->CCl2 +2Cl. l<220nm
->CCl2 +2Cl. l<220nm
Активный хлор может также образоваться в результате химических реакций хлорфторуглеводородов с возбужденным атомарным кислородом:
CFCl3 + O(1D)-> CFCl2 +ClO
CF2Cl2 +O(1D)->CF2Cl+ClO
CCl4 +O(1D)->CCl3 +ClO
Полностью галогенированные компоненты имеют большие химические времена жизни (около 65 лет F11 и около 120 лет F12), поэтому их разрушающее воздействие на озон может продолжаться еще долго после сокращения и даже прекращения их использования в промышленности.
Частично галогенированные компоненты могут разрушаться в тропосфере за счет взаимодействия с гидроксильными радикалами:
OH+CH3Cl->CH2Cl+H2O
OH+CH3CCl->CH2CCl+H2O
OH+CHF2Cl->CF2Cl+H2O,
в результате чего образуются оптически более стойкие к диссоциации газы и их разрушительное воздействие на стратосферный озон уменьшается. Однако значительная их часть все же проникает в стратосферу, где разрушается с высвобождением реактивного хлора аналогично полностью галогенированным компонентам:
CH3Cl + ->CH3 +Cl l<235nm
->CH3 +Cl l<235nm
CH3CCl+ ->CH CCl+ Cl l<250nm
->CH CCl+ Cl l<250nm
CHClF2 + ->CF2H+Cl l<210nm
->CF2H+Cl l<210nm
В связи с потенциальной опасностью для озона полностью галогенированных компонентов возникает естественное желание заменить их там, где это позволяют особенности производства частично галогенированными составляющими, которые менее опасны для озона, т.к. большая их часть разрушается в тропосфере. Однако, поскольку частично галогенированные компоненты все же оказывают разрушающее воздействие на озон, при оценке возможности их промышленного применения необходимо использовать об ективные количественные критерии, позволяющие учитывать озоноразрушающую опасность попадающих в атмосферу веществ и количественный уровень их выбросов в процессе индустриального производства.
Для количественной оценки озоноразрушающей опасности различных компонентов в настоящее время широко используется понятие "потенциалов озонного разрушения" [9], которые определяются путем сравнения с разрушающей способностью F11, отнесенной к единице потока на уровне земной поверхности. При этом принимается во внимание уменьшение только общего содержания озона. Для выяснения относительного вклада различных видов веществ нужно перемножить поток на уровне земной поверхности на потенциал озонного разрушения и сравнить полученные величины для рассматриваемых веществ.
Подобные оценки, проведенные для современного уровня выбросов с использованием одномерной фотохимической модели, показывают, что около 70 процентов хлорного разрушения озона происходят из-за F11 и F12, F113 дает около 10 процентов, а остальные галогенированные компоненты влияют на озон в меньшей степени [65]. Однако следует заметить, что роль многих компонентов еще до конца не выяснена. Так, четыреххлористый углерод ССl4 имеет высокий потенциал озонного разрушения, однако, точно не известен его поток. Выбросы метилхлороформа CH3CCl3 быстро растут (до 8 процентов в год), однако его потенциал озонного разрушения не очень высок (порядка 0.15). Влияние F-22 пока не играет существенной роли, однако он в последнее время рассматривается как возможный заменитель полностью галогенированных фреонов, что может привести к значительному увеличению его потока и, соответственно, его разрушающей для озона роли.
Помимо хлорных компонентов, значительную роль в разрушении стратосферного озона могут играть бромсодержащие атмосферные составляющие. Каталитический цикл разрушения озона бромными компонентами (2.21) имеет высокие скорости химических реакций, сравнимые с аналогичными в хлорном цикле, кроме того, озон может разрушаться в комбинированном хлорно-бромном цикле (1.23).
Влияние бромных компонентов на озон пока еще невелико, т.к. концентрации реактивного брома в стратосфере пока невелики. Однако, это влияние в ближайшие годы может усилиться, т.к. при тушении пожаров в последнее время интенсивно используются некоторые галоны (например Н-1211 - CBrClF и H-1301 - CBrF) [65].
Обеспокоенность мирового сообщества потенциальной опасностью хлор- и бромсодержащих компонентов для стратосферного озона привела к заключению Международных соглашений в Вене в 1985 г. О защите озонового слоя и Монреальского Протокола в 1987 году, определяющего порядок сокращения использования в промышленности полностью галогенированных компонентов. Для оценки потенциалов озонного разрушения их возможных промышленных заменителей предлагается разработанная автором двумерная среднезональная фотохимическая модель озоносферы.
 2014-02-09
2014-02-09 2816
2816






