∆Е гальв эл-та = Е0 окис-ля - Е0 восст-ля
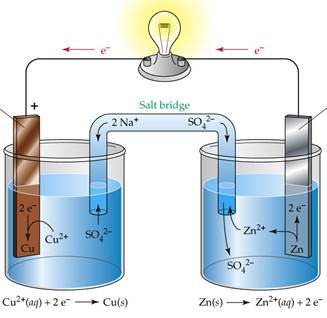
катод анод
E° (Zn2+/Zn)=-0,76 В
E° (Cu2+/Cu)=0,34 В
Анодом будет элемент, обладающий более отрицательным/меньшим значением Е0 (Zn), катодом – элемент с большим значением Е0 (Cu).
Разницу электродных потенциалов называют электродвижущей силой (э.д.с.) гальванического элемента ∆E.
∆E° = E°(Cu2+/Cu) – E°(Zn2+/Zn) =
= 0.34 – (- 0.76) = 1,10 В
Э.д.с. в гальванической реакции:
∆E = Eокис-ль – Eвосст-ль
В случае гальванического элемента: ∆E = Eкатода – Eанода
E°, ∆E° - электродный потенциал и э.д.с. при стандартных условиях
E, ∆E – электродный потенциал и э.д.с. при каких-то других условиях
При стандартных условиях:
T = 25°C = 298K aокис-ля=aвосст-ля=1M
(cокис-ля=cвосст-ля=1M)
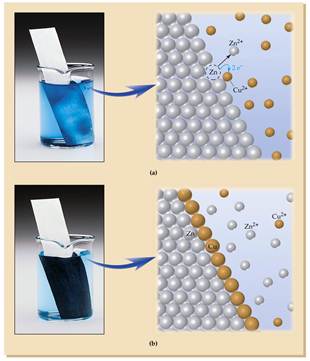
Окислительно-восстановительные потенциалы используются для описания и других редокс-систем (например, для характеристики окислительно-восстановительных реакций, протекающих в растворах).
Чем более положительна величина E0, тем с более сильным окислителем имеем дело; чем меньше значение E0, тем более сильным будет восстановитель.
 2014-02-09
2014-02-09 672
672







