Влияние давления (для реакций, идущих в газовой фазе).
Влияние концентрации реагирующих веществ.
На смещение химического равновесия
Влияние условий проведения реакции
При постоянстве внешних условий система может находиться в состоянии равновесия сколь угодно долго. Если оказать на систему какое-либо внешнее воздействие, равновесие нарушается; в системе возникает самопроизвольный процесс, продолжающийся до установления равновесия уже при новых условиях.
Если в равновесную реакционную смесь добавить исходное вещество, начнется самопроизвольный процесс, направленный в сторону его расходования и образования продуктов реакции. Такой же процесс будет протекать, если уменьшить концентрацию продуктов реакции, например, удалять их из реактора.
Давление влияет на положение равновесия только для реакций, протекающих с участием газообразных веществ. Направление смещения равновесия будет определяться знаком Δ n:
– если реакция идет с увеличением объема, т.е. Δn > 0, повышение давления сместит равновесие в сторону исходных веществ, выход продуктов сократится;
|
|
|
– для реакций, протекающих с уменьшением объема (Δn < 0), повышение давления будет способствовать увеличению выхода продуктов реакции.
Влияние давления на равновесные системы, в составе которых нет газов, пренебрежимо мало.
Воспользуемся уравнениями:
 ,
,
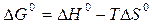 .
.
Совместным решением этих уравнений получим:
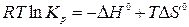 ,
,
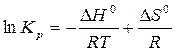 .
.
Полученное выражение продифференцируем по температуре:
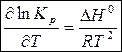 (7)
(7)
Уравнение (7) – уравнение изобары Вант-Гоффа – характеризует влияние температуры на константу химического равновесия.
Анализ уравнения.
Для экзотермических реакций D Н < 0, следовательно,
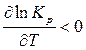 .
.
Это означает, что с повышением температуры константа равновесия экзотермической реакции уменьшается и равновесие смещается в сторону образования исходных веществ. Выход продуктов реакции сокращается.
Для эндотермических реакций D H > 0, следовательно,
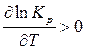 .
.
Это означает, что с повышением температуры константа равновесия эндотермической реакции возрастает и равновесие смещается в сторону увеличения выхода продуктов реакции.
Действие рассмотренных факторов обобщает принцип смещения равновесия, называемый также принципом Ле Шателье – Брауна:
 2014-02-12
2014-02-12 4177
4177