Теплоемкость.
Теплоемкость – свойство материала поглощать определенное количество тепла при нагревании и выделять его при охлаждении.
Удельная теплоемкость – количество тепла, необходимое для нагревания единицы количества вещества на один градус.
Формула для расчёта удельной теплоёмкости (или табл.знач.):
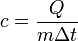 ,
,
где  — удельная теплоёмкость,
— удельная теплоёмкость,
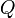 — количество теплоты, полученное веществом при нагреве (или выделившееся при охлаждении),
— количество теплоты, полученное веществом при нагреве (или выделившееся при охлаждении),
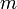 — масса нагреваемого (охлаждающегося) вещества,
— масса нагреваемого (охлаждающегося) вещества,
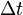 — разность конечной и начальной температур вещества.
— разность конечной и начальной температур вещества.
В зависимости от единиц измерения количества вещества различают:
· массовую теплоемкость С, Дж / (кг К) - это количество теплоты, которое необходимо подвести к единице массы вещества, чтобы нагреть его на единицу температуры;
· объемную теплоемкость С’, Дж / (м3 К) - это количество теплоты, которое необходимо подвести к единице объёма вещества, чтобы нагреть его на единицу температуры;
· мольную теплоемкость СМ, Дж / (кмоль К) - это количество теплоты, которое необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры.
Между различными видами теплоемкостей существует следующая зависимость:
С’ = СМ/22,4; С = СМ/М; С = С’/ρ.
Различают среднюю (Сm) и истинную (С) теплоемкость:
Сm = q1-2/(t2–t1), С = lim(q/t)=dq/dt=dq/dT,
где q1-2 – теплота, подводимая к газу в процессе нагревания от температуры t1 до температуры t2.
Истинная теплоемкость – первая производная от количества теплоты, подводимой в процессе нагрева к телу, по его температуре.
Теплоемкость газа не постоянна. Она зависит от температуры и давления. Влияние давления на теплоемкость газов незначительное, поэтому обычно учитывают только влияние температуры.
Зависимости средней теплоемкости от температуры:
если тело нагревается от 0 до некоторой температуры t: Сm =a+bt/2;
если тело нагревается от температуры t1 до температуры t2: Сm =a+b(t1+t2),
где a, b, – коэффициенты, зависящие от природы газа, определяются экспериментально и приводятся в справочных таблицах.
Теплоемкость зависит от способа подвода теплоты к газу. Чаще всего используют 2 способа:
при V = const (изохорный процесс) - Cv;
при P = const (изобарный процесс) - Ср.
Теплоемкости при постоянном давлении и постоянном объеме связаны между собой следующими соотношениями:
Ср = Cv + R – уравнение Майера; Ср / Cv = к, (1)
где R - газовая постоянная, Дж /(кг К);
к - показатель адиабаты, зависит от количества атомов в молекуле газа: для одноатомных газов - к = 1,66; для двухатомных газов - к = 1,4; для трех- и многоатомных - к = 1,33.
Анализ уравнений (1) показывает, что во время нагревания газа при P=const затрачивается тепла больше, чем при V=const.
Значение теплоемкости приближенно можно рассчитать следующим образом:
CV= R / (к - 1); CP= к R / (к – 1).
Массовую Ссм и объемную С’см теплоемость газовых смесей определяют по формулам:
Cсм = Σ (Ci gi); C’см= Σ (C’i ri),
где Ci– массовая теплоемкость отдельного газа, Дж/(кгК);
gi– массовые доли газов, составляющих смесь;
C’i– объемная теплоемкость отдельного газа, Дж/(м3К);
ri– объемные доли газов, составляющих смесь.
Количество теплоты, необходимое на нагрев тела, можно определить следующим образом:
Q = mС(t2-t1),
где С – удельная теплоемкость вещества.
Рассмотрим пример:
Газ (воздух) нагревается от начальной температуры t1=25oC до t2=130oC, масса газа m=21кг. Определить количество подведенного к воздуху тепла Q, считая удельную теплоемкость воздуха постоянной с=const=1,0301 кДж/кг·К. Выразить количество теплоты Q в килокалориях (ккал).
Решение:
Q = mС(t2-t1)=21·1,0301·(130-25)=2271 кДж·0,239=542,769ккал.
Ответ: Q = 2271 кДж=542,769ккал.
 2014-02-12
2014-02-12 48193
48193
