Энтальпия, термодинамическая функция Гиббса,
Если при передачи некоторого количества теплоты газу, он расширяется изобарно, то первое начало термодинамики для элементарного процесса в этом случае можно записать в виде:
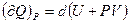 .
.
Величина, стоящая под знаком полного дифференциала, называется энтальпия или тепловая функция. Обозначают энтальпию буквой Н.
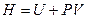 (4.74)
(4.74)
Энтальпия – функция состояния и может служить параметром состояния газа, если изменение состояния происходит изобарически.
Теплоёмкость изобарического процесса может быть выражена через энтальпию:
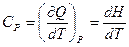 .
.
Энтальпия идеального газа зависит только от температуры. Для одного моля одноатомного газа энтальпия равна: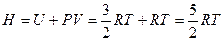 . В общем случае можно записать для любого количества молей любого идеального газа (не только одноатомного):
. В общем случае можно записать для любого количества молей любого идеального газа (не только одноатомного):
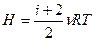 .
.
Для реальных газов энтальпия зависит не только от температуры, но и от объёма.
Для описания термодинамической системы используют так называемую характеристическую функцию или функцию Гиббса G. При независимых параметрах Т, Р и N (число частиц в системе) её можно записать в виде:
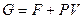 или
или 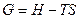 .
.
Функция Гиббса удобна для описания процессов в открытых системах, в которых возможен обмен веществом с окружающими телами. Она была введена Гиббсом в 1874 году.
Функция Гиббса, отнесённая к одной частице, называется химическим потенциалом. Функции состояния и функции процесса, рассмотренные выше, приведены в таблице 4.4.
 2014-02-13
2014-02-13 803
803








