В 1787 г. Шарль показал, что при постоянном давлении объем газа изменяется пропорционально его температуре. Закон Шарля чаще записывают в другом виде: V1IT1 = V2T1
Закон Шарля усовершенствовал Ж. Гей-Люссак, который в 1802 г. установил, что объем газа при изменении его температуры на 1°С изменяется на 1/273 часть того объема, который он занимал при 0°С. Отсюда следует, что если взять произвольный объем любого газа при 0°С и при постоянном давлении уменьшить его температуру на 273°С, то конечный объем окажется равным нулю. Это соответствует температуре -273°С, или 0 К. Такая температура называется абсолютным нулем. В действительности ее нельзя достичь.
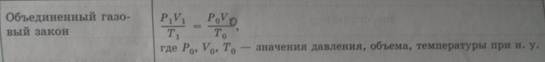

Классификация неорганических соединений. Молекулярные, графические и структурные формулы. Вещества с атомной, молекулярной и ионной кристаллической решеткой. Классификация веществ по степени чистоты. Основные методы очистки веществ: перегонка, перекристаллизация, фильтрование, возгонка, очистка газов методом поглощения примесей.
Простые вещества – вещества, молекулы которых состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения) – вещества, молекулы которых состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
Простые вещества разбиваются на две большие группы: металлы и неметаллы.
Металлы – группа элементов, обладающая характернымиметаллическими свойствами: твёрдые вещества (исключение составляет ртуть) имеют металлический блеск, являются хорошими проводниками теплоты и электричества, ковкие (железо (Fe), медь (Cu), алюминий (Al), ртуть (Hg), золото (Au), серебро (Ag) и др.).
Неметаллы – группа элементов: твёрдые, жидкие (бром) и газообразные веществ, которые не обладают металлическим блеском, являются изоляторы, хрупкие.
А сложные вещества в свою очередь подразделятся на четыре группы, или класса: оксиды, основания, кислоты и соли.
Оксиды – это сложные вещества, в состав молекул которых входят атомы кислорода и какого – нибудь другого вещества.
Основания – это сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами.
С точки зрения теории электролитической диссоциации, основания – сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид – анионы OH-.
Кислоты – это сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на атомы металла.
Соли – это сложные вещества, молекулы которых состоят из атомов металлов и кислотных остатков. Соль представляет собой продукт частичного или полного замещения атомов водорода кислоты металлом.
Молекулярная формула (molecular formula), выражение состава в-ва в виде хим. символов с указанием числа атомов каждого элемента в молекуле. Напр., этан будет записан как C2Н6; это означает, что его молекула состоит из двух атомов углерода и шести атомов водорода, соединенных ковалентной связью. М.ф. имеют только мол. соединения; ионные соединения, такие, как хлорид натрия (NaCl), а также гигантские сетчатые молекулы, как, напр., кремнезем (SiO2), не содержат отд. молекул, поэтому их формулы, называемые эмпирическими, показывают только численные соотношения между находящимися в соединениях атомами.
Структурная формула — это разновидность химической формулы, графически описывающая расположение и порядок связи атомов в (ковалентном) соединении, выраженное на плоскости[1].[2] Связи в структурных формулах обозначаются валентными черточками (штрихами).
Часто используются структурные формулы, где связи с атомами водорода не обозначаются валентными черточками (тип 2). В другом типе структурных формул (скелетных), применяемых для крупных молекул в органической химии, не указываются атомы водорода связанные с углеродными атомами и не обозначаются атомы углерода (тип 3).
Графические формулы служат для более наглядного изображения химического соединения. При таком изображении символы элементов соединены черточками, изображающими связующие электронные пары. Количество черточек у каждого элемента равно его валентности в данном соединении.
Графические формулы показывают последоьатель-ность соединения атомов в молекуле и валентность этих атомов.
Графическая формула - это условная структурная формула, которая может не совпадать с истинной структурной формулой. Графическая формула правильно передает степень окисления атомов, но не всегда соответствует истинному строению вещества.
Графические формулы показывают число связей между элементами.
Графическая формула - это условная структурная формула, которая может не совпадать с истинной структурной формулой. Графическая формула правильно передает степень окисления атомов, но не всегда соответствует истинному строению вещества.
Графические формулы показывают количество связей между элементами.
Графические формулы показывают число связей между элементами.
Графические формулы веществ - это формулы, которые показывают порядок соединения атомов в молекуле и валентность каждого элемента.
Графические формулы молекул кислот строят следующим образом.
Графическую формулу составляют так, чтобы число черточек одного элемента соответствовало числу черточек другого элемента.
Изобразите графические формулы мышьяко -; вых кислот.
Однако графические формулы не отражают пространственного расположения атомов.
В зависимости от вида частиц, находящихся в узлах кристаллической решетки и типа связей между ними кристаллы бывают четырехтипов: молекулярные, атомные, ионные и металлические.
Кристаллические решетки, состоящие из молекул (полярных и неполярных) называются молекулярными. Молекулы в таких кристаллических решетках соединены между собой сравнительно слабыми водородными, межмолекулярными и электростатическими силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления. Они малорастворимы в воде, не проводят электрический ток и обладают высокой летучестью. Примерами веществ с молекулярными решетками являются лед, твердый углекислый газ («сухой лед»), твердые галогенводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F2, Cl2, Br2, J2, H2, N2, O2), трех- (O3), четырех- (P4), восьми- (S8) атомными молекулами. Большинство кристаллических органических соединений также имеют молекулярную решетку.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называют атомными (ковалентными). Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером кристалла с атомной кристаллической решеткой может служить алмаз – одна из модификаций углерода. Данный кристалл состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами (к.ч. = 4).
Число веществ с атомной кристаллической решеткой велико. Все они имеют высокую температуру плавления, не растворимы в жидкостях, обладают высокой прочностью, твердостью, имеют широкий диапазон электропроводимости (от изоляторов и полупроводников до электронных проводников). Атомная кристаллическая решетка характерна для элементов III и IV групп главных подгрупп (Si, Ge, B, C).
Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером образования ионной кристаллической решетки может служить кристалл хлорида натрия (NaCl). Вещества с ионной кристаллической решеткой обладают высокой твердостью, хрупкостью, являются тугоплавкими и малолетучими. Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и ослаблению прочности связи между ними. Поэтому расплавы, растворы таких кристаллов проводят электрический ток. Вещества с ионными кристаллическими решетками легко растворяются в полярных жидкостях, являются диэлектриками. Ионные кристаллические решетки образуют многие соли, оксиды, основания.
Кристаллическая решетка, состоящая из атомов и ионов металлов, соединенных металлической связью, называется металлической.
Металлическая решетка является, как правило, весьма прочной. Этим объясняются свойственные большинству металлов твердость, малая летучесть, высокая температура плавления и кипения. Она же обусловливает такие характерные свойства металлов как электро- и теплопроводность, блеск, ковкость, пластичность, непрозрачность, фотоэффект. Металлической кристаллической решеткой обладают чистые металлы и сплавы.
При классификации веществ по степени чистоты применяют также след. термины. Высокочистыми часто называют вещества с наименее суммарной концентрацией примесей, которые удалось идентифицировать и определить. Для таких веществ число свойств, не зависящих от состава, будет наибольшим. Смеси нескольких особо чистых веществ иногда называют высокочистыми материалами. Часто встречающееся понятие суммарной чистоты не строго, т. к. существующие методы анализа не позволяют идентифицировать все примеси даже в простых веществах. Для обозначения идеального состояния вещества без примесей используют термин «абсолютно чистое вещество».
Основные методы очистки веществ: перегонка, перекристаллизация, фильтрование, возгонка, очистка газов методом поглощения примесей
Перегонка — способ разделения или очистки веществ, основанный на различных температурах кипения. В зависимости от свойств компонентов разделяемой смеси и разницы в их температурах кипения применяют различные типы и способы перегонки. Так, если целью перегонки является очистка вещества от практически нелетучих примесей, прибегают к простой перегонке. Примером может служить перегонка водопроводной воды с целью очистки от растворенных в ней минеральных солей, приводящая к получению дистиллированной воды. Частным случаем простой перегонки является перегонка с паром. Если при нагревании смеси два или большее число компонентов переходят в парообразное состояние, для их разделения приходится прибегать к фракционной перегонке. Оба вида перегонки — простая и фракционная — могут быть проведены как при атмосферном, так и при пониженном давлении (вакуум-перегонка).
Перегонке могут подвергаться не только жидкие, но и твердые при комнатной температуре вещества. По сравнению с перекристаллизацией перегонка дает, как правило, более высокий выход чистого продукта при меньших затратах времени.
Метод перекристаллизации основан на различной зависимости растворимости веществ и загрязняющих его примесей от температуры. Очистку вещества методом перекристаллизации проводят по следующей схеме: при повышенной температуре готовят насыщенный раствор очищаемого вещества, затем для удаления нерастворимых примесей раствор фильтруют через воронку для горячего фильтрования и охлаждают до низкой температуры. При понижении температуры растворимость вещества понижается и основная часть очищаемого вещества выпадает в осадок, растворимые примеси остаются в растворе, поскольку относительно них раствор остается ненасыщенным. Выпавшие кристаллы отделяют от маточного раствора и высушивают. В зависимости от свойств очищаемого вещества возможны различные методики проведения перекристаллизации.
Фильтрование – самый распространенный метод отделения твердых частиц от жидкости. При этом из раствора могут быть выделены не только диспергированные частицы, но и коллоиды.
В процессе фильтрования происходит задержание взвешенных веществ в порах фильтрующей среды и в биологической пленке, окружающей частицы фильтрующего материала. Вода освобождается от взвешенных частиц, хлопьев коагулянта и большей части бактерий.
Возгонкой называют процесс испарения твердого вещества с по-следующей конденсацией (сублимацией) паров в твердую фазу, минуя жидкую. При конденсации пара происходит непосредственно образова-ние твѐрдой фазы в виде оседающих на холодной поверхности кристал-лов.
Возгонке подвергаются лишь те вещества, упругость пара кото-рых в твердом состоянии достаточно велика при температуре ниже их температуры плавления. Температура, при которой давление пара над твердым веществом равно внешнему давлению, называется температу-рой возгонки. Давление паров увеличивается при нагревании, поэтому скорость возгонки возрастает с повышением температуры. Однако по-вышать температуру нужно с осторожностью во избежание разложения вещества. Снизить температуру возгонки можно, проводя процесс в ва-кууме.
Вещества, имеющие относительно высокую упругость пара, при нагревании могут приобрести давление пара, равное атмосферному, при температуре, меньшей температуры плавления. В этом случае темпера-тура плавления при нагревании вещества не достигается, и оно непо-средственно переходит в парообразное состояние, т.е. возгоняется.
Органические соединения с относительно высоким давлением па-ров могут возгоняться при атмосферном давлении при температуре ни-же их температуры плавления. Их относительно немного, и подавляю-щее большинство сублимируется только при сильно пониженном дав-лении. Этот метод лучше всего подходит в случае неполярных соедине-ний, которые обычно более летучи, чем полярные с аналогичной моле-кулярной массой; метод особенно ценен для соединений, которые гиг-роскопичны или расплавляются.
Возгонка – эффективный способ очистки веществ в тех случаях, когда загрязнения обладают иной летучестью, чем само вещество.
Преимущества возгонки заключаются в простоте, легкости испол-нения и минимальных потерях вещества. От перекристаллизации этот метод выгодно отличается отсутствием контакта с посторонним веще-ством (растворителем) и хорошим выходом. Нередки случаи, когда вы-ход чистого продукта достигает 98–99 %. Применение возгонки особен-
но желательно при работе с малыми количествами веществ в качестве конечной операции при получении образцов для анализа.
Главный недостаток возгонки в том, что процесс разделения зави-сит от разности в давлении паров, поэтому соединения со сходной лету-честью будут возгоняться вместе, то есть твердое вещество можно очи-стить возгонкой только в том случае, если оно имеет более высокое, чем примеси, давление пара. Очищенное таким образом вещество свободно от примесей.
Адсорбционные методы очистки основаны на поглощении примесей твердыми телами с развитой поверхностью, адсорбентами. Поглощаемые молекулы удерживаются на поверхности твердых тел силами Ван-дер-Ваальса(физическая адсорбция) или химическими силами (хемосорбция). Стадии адсорбции: - перенос молекул газа к внешней поверхности твердого тела – проникновение молекул газа в поры твердого тела – собственно адсорбция. Адсорбция рекомендуется для очистки газов с невысокой концентрацией вредных компонентов. Адсорбированные вещества удаляют из адсорбентов с помощью десорбции инертным газом или паром. Преимущество: высокая степень очистки. Недостатки: “чистые” (сухие и без пыли) газы, небольшая скорость. Адсорбенты – материалы высокоразвитой внутренней поверхностью(природные и синтетические): активированные угли, силикагели, алюмогели, цеолиты, иониты.
Активированные угли – гидрофобны. Для адсорбции газов и паров используют микропористые гранулированные активированные угли.
Силикагели – гидратированные аморфные кремнеземы (SiO(2)nH(2)O), являющиеся реакционно-способными соединениями переменного состава, превращения которых идет по механизму полконденсации. Зазоры м/у частицами образуют пористую структуру селикагеля. Получают путем осаждения аморфного кремнезема из силикатно-щелочных металлов. Служат для поглощения полярных веществ.
Алюмогели (Al(2)O(3)*nH(2)O где 0< n < 6) – получают прокаливанием различных гидроксидов алюминия. Используют для улавливания полярных органических соединений и осушки газов.
Цеолиты - алюмосиликаты, содержащие в своем составе оксиды щелочных и щелочноземельных
Металлов. Характеризуются регулярной структурой пор, соизмеримых с размерами молекул. Общая химическая формула: Me(2/n)C*Al(2)O(3)*xSi(2)*yH(2)O, где Me катион металла, n – его валентность. Получают синтетически и добывают при разработки месторождений. Обладают наибольшей адсорбцией по парам полярных соединений и веществ с кратными связями в молекулах.
Иониты - высокомолекулярные соединения с развитой поверхностью.
История формирования представлений о составе и строении вещества. Элементарный уровень организации вещества. Открытие электронов, протонов и нейтронов. Атомные ядра. Свойства и модели строения атомных ядер. Ядерные реакции. Изотопы, изотоны и изобары. Радиоактивность – свойство атомных ядер. Закон радиоактивного распада. Период полураспада. Радиоактивное равновесие.
Развитие представлений о строении вещества. В 1647 г. выходит книга французского философа П. Гассенди, в которой он пишет о том, что все тела состоят из атомов, аналогично тому как из строительных материалов построены дома. В телах атомы объединяются в группы, которые Гассенди назвал молекулами. Атомно-молекулярные представления о строении вещества развивал М. В. Ломоносов. Он объяснял свойства тел конфигурацией молекул, образующих эти тела, а изменение свойств тел в химических реакциях - изменением конфигураций молекул.
Химики получили веское доказательство существования атомов и молекул после того, как Джоном Дальтоном в 1807 г. был открыт закон кратных весовых отношений. Дальнейшее развитие химии связано с работами Лавуазье. С ними вошел в науку закон сохранения массы вещества. Дальнейшее развитие химии связано с работами Лавуазье. С ними вошел в науку закон сохранения массы вещества, в химии стали систематически применяться количественные методы, была выяснена роль кислорода в процессах горения и дыхания. К 1850 г. атомно-молекулярная теория стала господствующей и в химии, и в физике. Во многом этому способствовал шведский ученый Якоб Берцелиус. Он построил систему атомных весов всех известных тогда химических элементов. Накопление экспериментальных данных о химических и физических свойствах химических элементов позволило Д. И. Менделееву открыть периодический закон (1869 г.). В основу классификации элементов Д. И. Менделеев положил массу их атомов: как и другие сторонники механистического мировоззрения, основным свойством атомов он считал массу.
Элементарный уровень организации химического. Субстрат этого уровня организации представлен атомами как элементарным химическим. Организацию уровня выражает периодическая система элементов, где химические элементы сгруппированы по периодам и группам по общности своей химической природы, данной в их свойствах. Развернутая организация системы химических элементов есть разрешение противоречия «магистрали» и «тупиков» развития в процессе термоядерного синтеза химических элементов.
На «магистрали» развития элементарного уровня химического сосредоточена последовательность химических элементов, обладающих основным многообразием химических свойств в пределах элементарного уровня и включающих химический потенциал, реализуемый в организации следующего высшего уровня развития химического - в мире химических соединений, или молекулярном мире, куда и выводит далее «магистраль» развития, развертывающая природу (сущность) химического мира.
Исторически первой открытой элементарной частицей был электрон — носитель отрицательного элементарного электрического заряда в атомах.
Это самая «старая» элементарная частица. В идейном плане он вошел в физику в 1881 г., когда Гельмгольц указал, что атомная структура вещества вместе с законами электролиза Фарадея неизбежно приводит к мысли, что электрический заряд всегда должен быть кратен некоторому элементарному заряду, - т. е. к выводу о квантовании электрического заряда. Носителем отрицательного элементарного заряда, является электрон.
Максвелл же, не принимал гипотезы атомного электричества.
Между тем «временная» теория о существовании электрона была подтверждена в 1897 г. в экспериментах Дж. Дж. Томсона, в которых он отождествил так называемые катодные лучи с электронами и измерил заряд и массу электрона. Частицы катодных лучей Томсон называл «корпускулами» или изначальными атомами. Однако идея об электроне не сразу получила признание. Когда на лекции в Королевском обществе Дж. Дж. Томсон – первооткрыватель электрона – высказал предположение, что частицы катодных лучей следует рассматривать как возможные компоненты атома, некоторые его коллеги искренне считали, что он мистифицирует их. Сам Планк признавался в 1925 г., что не верил тогда, в 1900г., до конца в гипотезу об электроне. После опытов Милликена, измерившего в 1911г. заряды индивидуальных электронов, эта первая элементарная частица получила право на существование.
Протон был открыт Э. Резерфордом в 1919 г. в исследованиях взаимодействия альфа-частиц с атомными ядрами.
Точнее открытие протона связано с открытием атомного ядра. Оно было сделано Резерфордом в результате бомбардировки атомов азота высоко энергетическими α-частицами. Резерфорд заключил, что «ядро атома азота распадается вследствие громадных сил, развивающихся при столкновении с быстрой α-частицей, и что освобождающийся водородный атом образует составную часть ядра азота». В 1920 г. ядра атома водорода были названы Резерфордом протонами (протон по-гречески означает простейший, первичный). Были и другие предложения по поводу названия. Термин «протон» был существенно глубже и содержательнее, отражая фундаментальность протона, ибо протон – это простейшее ядро – ядро самого легкого изотопа водорода. Это, несомненно, один из наиболее удачных терминов в физике элементарных частиц. Таким образом, протоны — это частицы с единичным положительным зарядом и массой, в 1840 раз превышающей массу электрона.
Другая частица, входящая в состав ядра, — нейтрон — была открыта в 1932 Дж. Чедвиком при исследованиях взаимодействия α-частиц с бериллием. Нейтрон имеет массу, близкую к массе протона, но не обладает электрическим зарядом. Открытием нейтрона завершилось выявление частиц — структурных элементов атомов и их ядер.
Открытие изотопов не прояснило вопрос о строении ядра. К этому времени были известны лишь протоны – ядра водорода, и электроны, а потому естественной была попытка объяснить существование изотопов различными комбинациями этих положительно и отрицательно заряженных частиц. Можно было бы думать, что ядра содержат А протонов, где А – массовое число. При этом полный положительный заряд совпадает с атомным номером Z.
Такая простая картина однородного ядра поначалу не противоречила выводу о малых размерах ядра, вытекавшему из опытов Резерфорда. В 1920г. Резерфорд и другие ученые рассматривали возможность существования устойчивой комбинации из протона и электрона, воспроизводящей нейтральную частицу с массой, приблизительно равной массе протона. Однако из-за отсутствия электрического заряда такие частицы с трудом поддавались бы обнаружению.
Чедвик использовал также газообразный азот (в камере Вильсона, где вдоль следа заряженной частицы происходит конденсация водяных капелек) для поглощения излучения и измерения пробега атомов отдачи азота. Применив к результатам обоих экспериментов законы сохранения энергии и импульса, он пришел к выводу, что обнаруженное нейтральное излучение – это не гамма-излучение, а поток частиц с массой, близкой к массе протона. Чедвик показал также, что известные источники гамма-излучения не выбивают протонов.
Тем самым было подтверждено существование новой частицы, которую теперь называют нейтроном.
Открытие нейтрона явилось важным шагом вперед. Наблюдаемые характеристики ядер теперь можно было интерпретировать, рассматривая нейтроны и протоны как составные части ядер.
Нейтрон, как теперь известно, на 0,1% тяжелее протона. Свободные нейтроны (вне ядра) претерпевают радиоактивный распад, превращаясь в протон и электрон. Это напоминает о первоначальной гипотезе составной нейтральной частицы. Однако внутри стабильного ядра нейтроны связаны с протонами и самопроизвольно не распадаются.
А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что в более чем в 10 тысяч раз меньше размеров самого атома.
Атомное ядро состоит из нуклонов — положительно заряженных протонов и нейтральных нейтронов, которые связаны между собой при помощи сильного взаимодействия. Протон и нейтрон обладают собственным моментом количества движения (спином). Единственный стабильный атом, не содержащий нейтрон в ядре — лёгкий водород (протий). Единственный нестабильный атом без нейтронов - Гелий-2 (дипротон). Атомное ядро, рассматриваемое как класс частиц с определённым числом протонов и нейтронов, принято называть нуклидом.
Количество протонов в ядре называется его зарядовым числом — это число равно порядковому номеру элемента, к которому относится атом, в таблице Менделеева. Количество протонов в ядре определяет структуру электронной оболочки нейтрального атома и, таким образом, химические свойства соответствующего элемента. Количество нейтронов в ядре называется его изотопическим числом. Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами. Ядра с одинаковым числом нейтронов, но разным числом протонов — называются изотонами. Термины изотоп и изотон используются также применительно к атомам, содержащим указанные ядра, а также для характеристики нехимических разновидностей одного химического элемента. Полное количество нуклонов в ядре называется его массовым числом и приблизительно равно средней массе атома. Нуклиды с одинаковым массовым числом, но разным протон-нейтронным составом принято называть изобарами.
Строение и важнейшие свойства атомных ядер 1. Ядром называется центральная часть атома, в которой сосредоточена практически вся масса атома и его положительный электрический заряд. Все атомные ядра состоят из элементарных частиц: протонов и нейтронов, которые считаются двумя зарядовыми состояниями одной частицы - нуклона. Протон имеет положительный электрический заряд, равный по абсолютной величине заряду электрона. Нейтрон не имеет электрического заряда.
2. Зарядом ядра называется величина Ze, где е - величина заряда протона, Z - порядковый номер химического элемента, равный числу протонов в ядре. В настоящее время известны ядра с Z от Z=1 до Z=107.
3. Число нуклонов в ядре A=N+Z называется массовым числом. Нуклонам (протону и нейтрону) приписывается массовое число, равное единице, электрону - нулевое значение А.
Ядра с одинаковыми Z, но различными А называются изотопами. Ядра, которые при одинаковом А имеют различные Z, называются изобарами.
Всего известно около 300 устойчивых изотопов химических элементов и более 2000 естественных и искусственно полученных радиоактивных изотопов.
4. Размер ядра характеризуется радиусом ядра, имеющим условный смысл ввиду размытости границы ядра. Эмпирическая формула для радиуса ядра, может быть истолкована как пропорциональность объема ядра числу нуклонов в нем.
5. Ядерные частицы имеют собственные магнитные моменты, которыми определяется магнитный момент ядра в целом. Единицей измерения магнитных моментов ядер служит ядерный магнетон.
6. Распределение электрического заряда протонов по ядру в общем случае несимметрично. Мерой отклонения этого распределения от сферически симметричного является квадрупольный электрический момент ядра Q. Если плотность заряда считается везде одинаковой, то Q определяется только формой ядра.
ЯДЕРНЫЕ РЕАКЦИИ, превращения атомных ядер при взаимодействии с др. ядрами, элементарными частицами или квантами. Такое определение разграничивает собственно ядерные реакции и процессы самопроизвольного превращения ядер при радиоактивном распаде, хотя в обоих случаях речь идет об образовании новых ядер. Разграничивают р-ции на легких ядрах (массовое число ядра мишени А < 50), ядрах ср. массы (50 < А < 100) и тяжелых ядрах (А > 100). Ядерная реакция может произойти, если две участвующие в ней частицы сближаются на расстояние, меньшее диаметра ядра, т. е. на расстояние, при к-ром действуют силы внутриядерного взаимод. между составляющими ядра нуклонами. Если обе участвующие в ядерной реакции частицы заряжены положительно, то сближению частиц препятствует сила отталкивания двух положит. зарядов, и бомбардирующая частица должна преодолеть кулоновский потенциальный барьер. Высота этого барьера зависит от заряда бомбардирующей частицы и заряда ядра мишени. В случае, если в ядерной реакции участвуют частицы, не обладающие зарядом (нейтроны), кулоновский потенциальный барьер отсутствует, и ядерные реакции могут протекать с участием частиц, имеющих тепловую энергию (т. е. энергию, отвечающую тепловым колебаниям атомов). Обсуждается возможность протекания ядерных реакций не в результате бомбардировки ядер мишени налетающими частицами, а за счет сверхсильного сближения ядер, находящихся в твердой матрице или на пов-сти твердого тела. Ядерные реакции подчиняются тем же общим законам природы, что и обычные хим. р-ции (закон сохранения массы и энергии, сохранения заряда, импульса). Кроме того, при протекании ядерных реакций действуют и некоторые специфические законы, не проявляющиеся в хим. р-циях, напр., закон сохранения барионного заряда.
1. Если у ядер одинаково число протонов Z=const, то такие ядра называются изотопами.
2. Если у ядер одинаково массовое число A=const, то такие ядра называются изобарами.
3. Если у ядер одинаково число нейтронов A-Z=const, то такие ядра называются изотонами.
Радиоактивность — свойство атомных ядер самопроизвольно (спонтанно) изменять свой состав (заряд Z, массовое число A) путём испускания элементарных частиц или ядерных фрагментов. Соответствующее явление называется радиоактивным распадом. Радиоактивностью называют также свойство вещества, содержащего радиоактивные ядра.
Установлено, что радиоактивны все химические элементы с порядковым номером, большим 82 (то есть начиная с висмута), и многие более лёгкие элементы (прометий и технеций не имеют
стабильных изотопов, а у некоторых элементов, таких как индий, калий или кальций, часть природных изотопов стабильны, другие же радиоактивны).
Естественная радиоактивность — самопроизвольный распад ядер элементов, встречающихся в природе.
Искусственная радиоактивность — самопроизвольный распад ядер элементов, полученных искусственным путем через соответствующие ядерные реакции.
Закон радиоактивного распада: dN / dt = -лN
что означает, что число распадов за интервал времени t в произвольном веществе пропорционально числу имеющихся в образце атомов N.
В этом математическом выражении л — постоянная распада, которая характеризует вероятность радиоактивного распада за единицу времени и имеющая размерность с−1. Знак минус указывает на убыль числа радиоактивных ядер со временем.
Этот закон считается основным законом радиоактивности, из него было извлечено несколько важных следствий, среди которых формулировки характеристик распада — среднее время жизни атома и период полураспада.
Период полураспада — время, в течение которого испытывает радиоактивные превращения половина ядер атомов данного изотопа. Обозначается буквой Т. Закон радиоактивного распада — уменьшение с течением времени количества активных атомов — является общим для всех видов радиоактивных превращений и всех радиоактивных изотопов: количество радиоактивных атомов данного изотопа, распадающихся за 1 сек., пропорционально их количеству. Доля атомов, распавшихся за 1 сек., для данного изотопа не зависит от количества активных атомов и времени. Эта величина называется постоянной радиоактивного распада λ. Она измеряется в единицах, обратных времени: сек-1, мин.-1, сут.-1, год-1. Для каждого вида радиоактивных ядер и превращений λ имеет свое значение. Так, для Na24 λ =1,29·10-6 сек.-1, Ra226 — 1,38·10-11 сек.-1. Закон радиоактивного распада справедлив только для большого количества радиоактивных атомов.
Радиоактивное равновесие - Состояние динамического равновесия в радиоактивном ряду. При радиоактивном равновесии количество образующихся в единицу времени атомов любого промежуточного радиоэлемента равно количеству его распадающихся атомов. В минералах, содержащих уран и торий, радиоактивное равновесие наступает за время, определяемое периодом полураспада наиболее долгоживущего дочернего вещества: в урановом ряду - иония с периодом полураспада 83 000 лет; в ториевом ряду - мезотория I с периодом полураспада 6,5 года. Радиоактивное равновесие в радиоактивных рядах наступает практически через 10 кратный период полураспада указанных дочерних веществ. Следовательно, в урановых минералах радиоактивное равновесие наступает через 830 000 лет с момента их образования, в ториевых минералах - через 65 лет. В минералах и породах часто наблюдаются случаи нарушения радиоактивного равновесия.
Атомный уровень организации вещества. История развития и формирования представлений о строении атома. Модели строения атома. Теория Н.Бора строения атома водорода. Круговые и эллиптические орбиты. Эффекты Штарка и Зеемана. Атомные спектры. Спектр атома водорода. Квантовые числа.
Атомный уровень организации вещества. Все химические превращения в неживой и живой природе происходят на уровне атомов и молекул.Атом состоит из заряженных частей. Подобно солнечной системе, он имеет центральную часть и окружение. Практически вся масса атома сосредоточена в ядре. Непрерывно движущиеся электроны охватывают громадную по сравнению с ядром область пространства. Если представить ядро атома водорода с горошину, то область движения электрона будет охватывать сферу радиусом более 100 м.
Атом это микросистема, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в поле ядра. Атом – микросистема, потому что реальный размер любого атома имеет порядок 1010 м.
История развития представлений о строении атомного ядра Все тела окружающей нас живой и неживой природы состоят из мельчайших частиц - атомов. Атом мельчайшая неделимая частица образующая вещество. Атомы имеют форму правильных многогранников: куба («атомы земли»), тетраэдра («атомы огня».), октаэдра («атомы воздуха»), икосаэдра («атомы воды»).
К началу двадцатого века физики уже имели достаточно информации о массе и размерах атома. К тому времени стало ясно, что атомы не являются мельчайшими частицами в составе вещества. Они обладают определенной внутренней структурой, разгадка которой позволила бы объяснить периодичность свойств химических элементов. Однако только эксперименты английского физика Эрнеста Резерфорда послужили основой для создания современной протонно-нейтронной модели атома.
Изучение атомного ядра неотделимо от изучения элементарных частиц. Японский физик Хантаро Нагаока представил строение атома аналогичным строению Солнечной системы в центре атома располагается его положительно заряженная часть (она сравнивалась с Солнцем, вокруг которой по установленным кольцеобразным орбитам подобно планетам движутся электроны. Смещение электронов со своих орбит приводит к возбуждению электромагнитных волн.
Английский физик Джизеф Джон Томсон предложил модель атома в виде положительно заряженной по всему объему сферы диаметром 10х10 м, внутрь которой вкраплены электроны. Положительный заряд сферы компенсируется суммарным отрицательным зарядом электронов. Излучение света происходит в результате колебания атомов относительно центра сферы.
Томсон расположил электрон в атоме водорода в центре положительно заряженной сферы. В многоэлектронных атомах электроны помещались в устойчивые конфигурации, параметры которых могли быть рассчитаны. Томсон считал, что именно конфигурация электронов определяет химические свойства атомов.
Модели строения атома. Первые указания о сложном строении атома были получены при изучении процессов прохождения электрического тока через жидкости. Опыты выдающегося английского ученого М.Фарадея в тридцатых годах XIX в. навели на мысль о том, что электричество существует в виде отдельных единичных зарядов.Величины этих единичных зарядов электричества были определены в более поздних экспериментах по пропусканию электрического тока через газы (опыты с так называемыми катодными лучами). Было установлено, что катодные лучи — это поток отрицательно заряженных частиц, которые получили названия электронов.Прямым доказательством сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью.. Последовавшее за этим установление природы α-, β-, и γ-лучей, образующихся при радиоактивном распаде, открытие ядер атомов, определение заряда электрона позволили Э.Резерфорду в 1911 г. предложить одну из первых моделей строения атома.
Модель Резерфорда. Суть планетарной модели строения атома (Э.Резерфорд, 1911 г.) можно свести к следующим утверждениям:
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е.м.).
3. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра.
Эта модель оказалась очень наглядной и полезной для объяснения многих экспериментальных данных.
1913 г. Н. Бор предложил свою теорию строения атома, в которой ему удалось с большим искусством согласовать спектральные явления с ядерной моделью атома, применив к последней так называемую квантовую теорию излучения, введенную в науку немецким ученым-физиком Планком. Сущность теории квантов сводится к тому, что лучистая энергия испускается и поглощается не непрерывно, как принималось раньше, а отдельными малыми, но вполне определенными порциями - квантами энергии.
Запас энергии излучающего тела изменяется скачками, квант за квантом; дробное число квантов тело не может ни испускать, ни поглощать.
Постулат Планка (1911): свет излучается и поглощается квантами: E=h*n,
где h – постоянная Планка, 6,626*10-34 Дж*с, n=с/l, c – скорость света, l - длина волны.
Н. Бор, используя модель Резерфорда и теорию Планка предложил модель строения атома водорода. Бор сформулировал свои постулаты:
1. Электрон в атоме находится в «стационарном» состоянии (движется по стационарной орбите) и никакой энергии не излучает.
2. Будучи выведен из стационарного состояния (переведен на другую орбиту), электрон возвращаясь, излучает квант света h*n=E2-E1.
3. Электрон в атоме может находиться только на тех «разрешенных» орбитах, для которых момент количества движения (mvr) принимает некие дискретные значения.
Теория Бора позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов.
Достижения теории Н. Бора: Описал радиус атома водорода; Определил энергию его ионизации;
Описал количественно спектр атома водорода.
Недостатки теории: Не удается описать спектры многоэлектронных атомов, поведение атомов в магнитном поле.
Из сходства между законом Кулона и законом тяготения Ньютона возникла ясная идея: электроны обращаются вокруг ядра по круговым и эллиптическим орбитам, так же как планеты вокруг Солнца. Возникла планетарная модель атома - сила притяжения компенсируется в ней центробежной силой.
Под действием сил всемирного тяготения звезды Галактики движутся вокруг ее центра по круговым и эллиптическим орбитам. Скорость галактического вращения на различных расстояниях от центра разная.
В 1896 П.Зееман обнаружил, что в спектре образца, помещенного во внешнее магнитное поле, каждая спектральная линия расщепляется на ряд компонент. Аналогичный эффект, но во внешнем электрическом поле, наблюдал И.Штарк в 1913. Для изучения атомов удобнее применять магнитное поле, а для исследования молекул больше подходит электрическое поле.
АТОМНЫЕ СПЕКТРЫ — оптические спектры свободных или слабо связанных атомов (одноатомных газов, паров). Обусловлены квантовыми переходами атома. Атомные спектры — линейчатые, состоят из отдельных спектральных линий, которые характеризуются определенной длиной волны и для простых атомов группируются в спектральные серии. Содержат информацию о строении атомов, используются также в спектральном анализе.
Спектр поглощения водорода можно получить при пропускании через него электромагнитного излучения с непрерывным спектром. Тогда после прохождения через коллиматор и призму излучение на экране разворачивается в спектр, представляющий собой радугу на фоне которой заметны тонкие черные полоски. Черным полоскам соответствуют частоты, определяемые формулой. Таким образом, спектр излучения и спектр поглощения водорода взаимно дополняют друг друга до радуги.
Для получения спектра испускания водорода его необходимо разогреть до высокой температуры и излучение пропустить через оптическую систему, состоящую из коллиматора и призмы. При этом на экране, размещенном за призмой, можно наблюдать тонкие цветные линии, образующие спектральную серию, называемую серией Бальмера.
Квантовые числа - это энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится. Квантовые числа необходимы для описания состояния каждого электрона в атоме. Всего 4-ре квантовых числа. Это: главное квантовое число - n, орбитальное квантовое число - l, магнитное квантовое число - ml и спиновое квантовое число - ms.
 2015-01-30
2015-01-30 2804
2804
