Вытеснение из солей сильными кислотами:
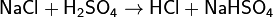
Хлор, бром, иод непосредственно взаимодействуют с водородом, образуя галогеноводороды:
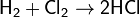
Хлор реагирует с водородом бурно, со взрывом, но реакцию необходимо инициировать (путём нагревания или освещения), что связано с её цепным механизмом.
Взаимодействие водорода с бромом и иодом также включает цепные процессы, но реакция с бромом протекает медленно, а с иодом идёт лишь при нагревании и не доходит до конца, поскольку в системе устанавливается равновесие. Этой закономерности соответствует и изменение ΔH°f.
Фтороводород — бесцветный газ с резким запахом, при комнатной температуре существует преимущественно в виде димера H2F2, ниже 19,9°C — бесцветная подвижная жидкость. Смешивается с водой в любом отношении с образованием фтороводородной кислоты. Образует с водой азеотропную смесь с концентрацией 35,4 % HF.
Строение молекулы
Молекула фтороводорода сильно полярна, μ = 0,64×10 Кл·м. Фтороводород в жидком и газообразном состояниях имеет большую склонность к ассоциации вследствие образования сильных водородных связей. Энергия водородных связей FH•••FH приблизительно составляет 42 кДж/моль, а средняя степень полимеризации в газовой фазе ≈4. Даже в газообразном состоянии, фтороводород состоит из смеси полимеров H2F2, H3F3, H4F4, H5F5, H6F6. Простые молекулы HF существуют лишь при температурах выше 90 °C. Вследствие высокой прочности связи, термический распад фтороводорода становится заметным лишь выше 3500 °C. Для сравнения — у воды термический распад становится заметным при температурах выше 2000 °C.
В кристаллическом состоянии HF образует орторомбические кристаллы, состоящие из цепеобразных структур: угол HFH = 116 °, d = 95 пм, d = 155 пм. Аналогичные зигзагообразные цепи с углом HFH = 140°) имеют и полимеры HF, существующие в газовой фазе.
Химические свойства. Химические свойства HF зависят от присутствия воды. Сухой фтористый водород не действует на большинство металлов и не реагирует с оксидами металлов. Однако если реакция начнется, то дальше она некоторое время идет с автокатализом, так как в результате взаимодействия количество воды увеличивается:

Жидкий HF — сильный ионизирующий растворитель. Все электролиты, растворённые в нём, за исключением хлорной кислоты HClO4, являются основаниями:
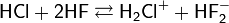
В жидком фтороводороде кислотные свойства проявляют соединения, которые являются акцепторами фторид ионов, например BF3, SbF5:
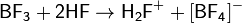
Амфотерными соединениями в среде жидкого фтороводорода являются, например, фториды алюминия и хрома(III):
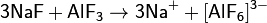
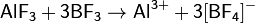
Фтороводород неограниченно растворяется в воде, при этом происходит ионизация молекул HF:
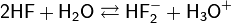
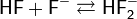
В водном растворе HF (плавиковая кислота) является кислотой средней силы. Соли плавиковой кислоты называются фторидами. Большинство их трудно растворимо в воде, хорошо растворяются лишь фториды Na, К, Ag, Al, Sn, Ni, и Mn. Все соли плавиковой кислоты ядовиты.
Фтористоводородная (плавиковая) кислота НР применяется в химической промышленности для получения фтористых солей, на металлургических заводах для очистки отливок от формовочного песка, а также в производстве строительных материалов и керамики. Плавиковая кислота растворяет цинк и железо, очень медленно свинец, медь и серебро, не реагирует с золотом и платиной.
 2015-01-30
2015-01-30 1413
1413








