для разрушения силикатных горных пород;
растворения металлов (тантала, циркония, ниобия и др.);
катализатор гидрирования;
катализатор дегидрирования;
катализатор алкилирования в органической химии;
реагент в производстве хладонов и фторопластов;
исходное вещество для получения фтора;
производство фторсульфоновой кислоты;
встречается в производстве суперфосфатов, алюминия, урана, бериллия и марганца; плавильных флюсов; при сварке электродами, в состав обмазки которых входят соединения фтора, или при электросварке под флюсом.
Соляная кислота применяется в химической, медицинской, пищевой промышленности, цветной и черной металлургии. Кислота соляная также применяется в производстве пластмасс, ядохимикатов, полупродуктов и красителей для очистки поверхности металлов от окислов, карбонатов, в электротехнической, текстильной промышленности. Кислота соляная ингибированная марка А – применяется для кислотной обработки скважин в нефтяной промышленности с целью улучшения сообщаемоести скважин с пластом.
Кислота соляная марки Б – применяется для травления черных и некоторых цветных металлов и изделий из них, для химической очистки котлов и аппаратов от неорганических отложений.
Галогени́ды (галоиды) — соединения галогенов с другими химическими элементами или радикалами. При этом галоген, входящий в соединение, должен быть электроотрицательным; так, оксид брома не является галогенидом.
Процессы гидролиза галогенидов.
Замена атома галогена в алкилгалогенидах на гидроксилв синтетических целях используется редко, так как они сами обычно получаются из спиртов.
Реагентами в этих реакциях являются вода, водные растворы щелочей и кислот.
Слабый нуклеофил вода используется лишь для гидролиза галогенидов с повышенной реакционной способностью. Кипячение аллил- и бензилхлоридов в избытке воды приводит к образованию соответствующих спиртов. В остальных случаев даже при нагревании эта обратимая реакция идет очень медленно по SN1 или SN2 механизму:

В большинстве случаев для гидролиза алкилгалогенидов применяются водные растворы гидроксидов щелочных металлов или гидроксид серебра (суспензия оксида серебра в воде), которые являются более активными нуклеофильными реагентами:


В зависимости от структуры субстрата и условий проведения реакции могут протекать вторичные процессы.
Водные растворы кислот используются крайне редко и только тогда, когда кислота активирует субстрат. Чаще всего это встречаетсяпри гидролизе гетероциклических галогенидов.
Алкилгалогениды нерастворимы в воде, поэтому для гомогенизации реакционной массы при гидролизе часто используют спирто-водную или водно-ацетоновую среды.
Гидролиз геминальных дигалогенпроизводных(с галогенами у одного атома углерода) используется для синтеза альдегидов или кетонов, например, в производстве димедрола:
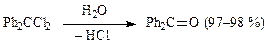
Алифатические альдегиды и кетоны получают в слабощелочной среде в водных растворах карбонатов, ацетатов, формиатов или оксалатов натрия или калия, так как в сильнощелочных средах возможны побочные процессы: конденсации, окисление альдегидов и др.
Бензилиденхлориды и бензилиденбромиды гладко гидролизуются до бензальдегидов под действием концентрированной серной кислоты (SN1). Электронодонорные группы в ядре облегчают гидролиз, электроноакцепторные — затрудняют. В последнем случае следует повысить температуру реакции до 120—130 °С (но не выше, т.к. при более высокой температуре альдегиды будут интенсивно окисляться серной кислотой).
Гидролиз соединений, содержащих три атома галогенау одного атома углерода, приводит к образованию карбоновых кислот, однако они труднодоступны и практическое применение метода ограничено:
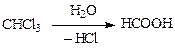
Галогены – простые вещества. Физические и химические свойства. Получение и применение. Изменение энергии связи в двухатомных молекулах галогенов. Окислительные свойства, их изменение по подгруппе. Токсичность галогенов. Формы нахождения в природе. Получение галогенов. Применение. Особенности фтора.
Галогены. Положение в периодической системе. Элементы VIIA-группы периодической системы — галогены: фтор F, хлор ('.I, бром Вг, иод I и редко встречающийся в природе астат At — типичные неметаллы.
Названия галогенов образованы в соответствии с их свойствами: фтор — в переводе с греческого языка «разрушающий», хлор — «желто-зеленый», бром — «зловонный», иод — «фиолетовый». Электронная конфигурация внешнего электронного слоя атомов галогенов цу'пр5: фтор — 2s22p5, хлор — 3s23p5, бром — 4s24/?5, иод — 5s25p5, астат — I» например KF, НС1 и т. д. Хлор С1, бром Вг, иод I и астат At в соединениях с более электроотрицательными элементами (фтором, кислородом, азотом) проявляют положительные степени окисления +1, +3, +5, +7, например: НС10, +3 +5 +7 HBr02, BrF5, Н5Ю6. Для фтора характерна постоянная степень окисления — 1.
Физические свойства. Простые вещества галогены состоят из двухатомных молекул. При обычных условиях фтор и хлор — газы, бром — жидкость, иод и астат — твердые вещества. Температуры плавления и кипения простых веществ галогенов сверху вниз по группе повышаются.
Все галогены — окрашенные вещества. Галогены имеют характерный резкий запах, являются весьма токсичными. Они хорошо растворяются в органических растворителях, хуже — в воде.
Получение. В лаборатории хлор получают действием концентрированной соляной кислоты на перманганат калия:
16НС1 + 2КМп04 = 5С12Т + 2КС1 + 2МпС12 + 8Н20.
Основным методом промышленного получения хлора является электролиз водных растворов хлоридов:
·2NaCl + 2Н20 = 2NaOH + Cl2t + H2t.
При этом образуются еще два ценных химических продукта — водород и гидроксид натрия. Фтор в промышленных масштабах получают электролизом расплавов фторидов, а бром и иод — действием хлора на растворы бромидов и иодидов соответственно:
· 2NaBr + С12 = 2NaCl + Вг2;
· 2NaI + С12 = 2NaCl + 12.
Химические свойства. Химические реакции с металлами галогены ведут себя как окислители. Так, фтор уже при обычных условиях реагирует с большинством металлов, а алюминий и цинк в атмосфере фтора воспламеняются: +2 -1:ZnF2.
В колбе, наполненной хлором, красиво вспыхивают и сгорают кристаллики измельченной сурьмы, образуя при этом смесь двух хлоридов сурьмы (III) и (V):
· 2Sb + ЗС12 = 2SbCl3;
· 2Sb + 5С12 = 2SbCl5.
Галогены способны окислять и неметаллы. Но если фтор взаимодействует с водородом в любых условиях со взрывом, то реакция иода с водородом протекает медленно даже при нагре-илиии. Следовательно, реакционная способность галогенов по отношению к водороду понижается при переходе от фтора к иоду.
Окислительная способность фтора по отношению к другим галогенам проявляется в образовании межгалогенных соединений (интергалогенидов). Эти соединения образуются при сочетании двух разных галогенов. Степень окисления фтора в них всегда равна — 1, а степени окисления других галогенов изменяются от + 1 до +7, например: фторид хлора(III) C1F3, фторид брома(У) BrF5, фторид иода(УН) IF7.
Каждый галоген является самым сильным окислителем в своем периоде. По группе от хлора к иоду окислительные свойства простых веществ галогенов уменьшаются. Рассматривая изменение окислительных свойств галогенов по группе, необходимо отметить, что каждый вышестоящий элемент вытесняет последующий из растворов галогеноводородных кислот и их солей. Так, хлор вытесняет бром и иод из растворов бромидов и иодидов, например:
· С12 + 2КВг = 2КС1 + Вг2.
Бром вытесняет иод:
· Вг2 + 2NaI = 2NaBr + I2.
В качестве окислителей галогены выступают и по отношению ко многим органическим соединениям, например:
· СН4 + С12 Н СН3С1 + НС1.
 2015-01-30
2015-01-30 1976
1976








