Люминесценция – избыточное по сравнению с тепловым излучение, возникающее через некоторое время (Δ τ > 10–8 с) после поглощения веществом энергии извне. Если излучение возникает в результате поглощения излучения рентгеновского или ультрафиолетового диапазона, его называют флуоресценцией. Процессы в многоатомной молекуле, приводящие к флуоресценции, позволяет обсудить энергетическая схема, представленная на рис. 1.19.
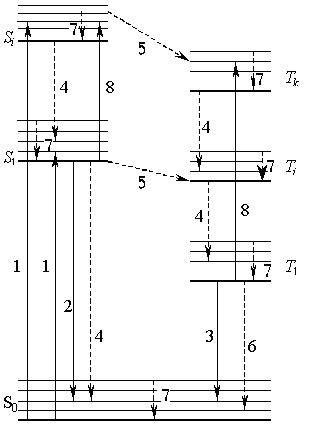
Рис. 1.19. Энергетическая схема многоатомной молекулы:
1 – поглощение; 2 – флуоресценция; 3 – фосфоресценция; 4 – внутренняя конверсия; 5 – синглет-триплетная конверсия; 6 – Т 1 – S 0 – конверсия; 7 – колебательная релаксация; 8 – синглет-синглетное и триплет-триплетное перепоглощение
1.5.1. Природа люминесцентного излучения
Изображены основной S 0 и возбужденные (синглетные S 1и триплетные T 1) электронные уровни молекулы. Синглетному состоянию соответствуют антипараллельные спины электронов, триплетному – параллельные. Переход основного синглетного в возбужденное триплетное состояние запрещен по спину и практически не наблюдается. В пределах каждого электронного уровня имеются колебательные подуровни. Излучательный переход S 0 → S 1называют флуоресценцией, спонтанный T 1 → S 0 – фосфоресценцией.
В рассматриваемой системе наблюдаются процессы безызлучатель-ной дезактивации – неоптические (не сопровождающиеся непосредственно излучением фотона) переходы между электронными состояниями, при которых энергия электронного возбуждения полностью или частично преобразуется в колебательную энергию системы. Различают два вида безызлучательной конверсии – внутреннюю и интеркомбинационную. Первая имеет место между электронными состояниями одной мультиплетности (Sn → Sm, S 0 → S 1, T l → Tk), вторая – между состояниями разной мультиплетности (Sn → Tm, T 1 → S 0). Безызлучательный переход в основное состояние часто называют деградацией (S 1 → S 0, Т 1 → S 0). Имеет место еще один вид безызлучательных переходов – колебательная релаксация, которая в отличие от внутренней конверсии протекает в рамках одного электронного состояния и приводит к установлению равновесного распределения энергии по колебательным уровням электронного состояния возбужденной молекулы в результате внутримолекулярных взаимодействий и (или) взаимодействия со средой. При безызлучательных переходах теряется часть поглощенной энергии и излучение наблюдается при большей длине волны, чем λ поглощенного кванта.
1.5.2. Закономерности флуоресценции
Правило Стокса. Спектр флуоресценции многоатомных молекул представляет широкую структурную или бесструктурную полосу, сдвинутую в сторону длинных волн относительно спектра поглощения.
Правило Стокса означает, что молекула излучает не всю поглощенную энергию, часть поглощенной энергии тратится на внутримолекулярные преобразования. Иными словами, данное правило указывает, что частота излучаемого кванта (vf) должна быть меньше частоты поглощенного кванта (vа), т.е. hvf < hvа.
Важными характеристиками флуоресценции являются квантовый выход
В кв = n изл / n погл,
В эн = Е изл / Е погл,
где n изл, n погл– соответственно число излученных и поглощенных квантов, а Е изл, Е погл –энергия излученных и поглощенных квантов.
Правило М. Каша (1950 г.): в большинстве молекул процессы внутренней конверсии между электронно-возбужденными состояниями протекают за время, меньшее, чем 10–11 с, и заметный квантовый выход флуоресценции может наблюдаться только для переходов из нижнего возбужденного состояния данной мультиплетности.
Закон С.И. Вавилова (1924 г.): квантовый выход флуоресценции остается постоянным при возбуждении различными длинами волн на всем протяжении полосы поглощения вплоть до некоторой предельной величины λ 0. Закон Вавилова в конденсированных средах обусловлен тем, что вследствие межмолекулярных взаимодействий происходит передача в среду избытка над равновесным значением колебательной энергии в электронно-возбужденном состоянии и устанавливается равновесное распределение по колебательным степеням свободы.
Закон зеркальной симметрии. В 1931 г. В.Л. Левшиным было обнаружено, что контур полосы флуоресценции является зеркальным отражением длинноволновой полосы поглощения (оба спектра построены в шкале частот). Как показал Б.И. Степанов, для выполнения правила зеркальной симметрии необходимо наличие равновесного распределения поглощенной энергии по колебательным степеням свободы в состоянии S 1, т.е. высокой скорости колебательной релаксации во флуоресцентном состоянии, что характерно только для сложных по строению молекул.
1.5.3. Факторы, влияющие на интенсивность флуоресценции
Зависимость интенсивности флуоресцентного излучения I от концентрации излучающего вещества С проходит через максимум. Для очень малых значений С (от 0 до 10–3 моль/дм3) наблюдается линейная зависимость
I = k · С.
Дальнейшее увеличение С приводит к концентрационному тушению флуоресценции. Типичная зависимость представлена на рис. 1.20. В диапазоне от 0 до 15 мкг/см3 соблюдается линейная зависимость интенсивности флуоресценции от концентрации фенола. В этом диапазоне обсуждаемым методом успешно осуществляется количественный анализ при высокой чувствительности.
Повышение температуры усиливает колебательные переходы в молекулах и резко снижает интенсивность флуоресценции (температурное тушение). Измерения желательно проводить при более низкой температуре, используя термостатирование.
На интенсивность флуоресценции существенное влияние оказывает кислотность раствора. Например, максимум спектра флуоресценции акридина при изменении рН от 7 до 4 смещается от 430 до 475 нм. При этом изменяется и форма спектра. Характер зависимости от рН индивидуален для каждого исследуемого вещества, и влияние этого фактора существенное. Поэтому рекомендуется аналитические определения проводить в буферных средах.
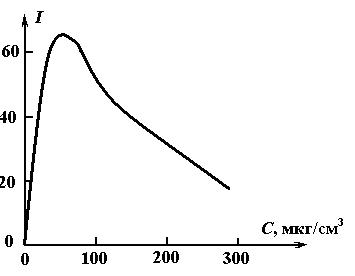
Рис. 1.20. Влияние концентрации фенола в водном растворе
на интенсивность его флуоресценции
Для флуоресценции многих веществ характерно тушение излучения посторонними веществами. Этот эффект применяется в количественном анализе. На рис. 1.21 приведена зависимость интенсивности флуоресцен-ции родаминового раствора от содержания в нем ионов Zn2+. Градуировочная кривая, построенная по эталонным растворам, позволяет вести количественное определение концентрации цинка.
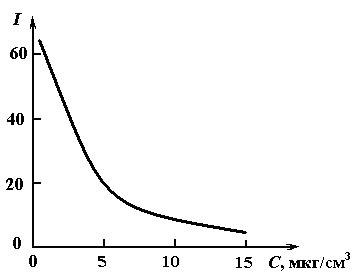
Рис. 1.21. Влияние концентрации ионов цинка
на интенсивность флуоресценции родаминового раствора
Флуориметрические измерения проводят на флуориметрах (рис. 1.22) – приборах, позволяющих выделить в падающем на кювету световом потоке при помощи светофильтра 2 длину волны ультрафиолето-вого диапазона, соответствующую максимуму поглощения молекулами или ионами анализируемого вещества. Второй светофильтр 4 выделяет в световом потоке вторичного (флуоресцентного) излучения длину волны, соответствующую максимуму интенсивности излучения.
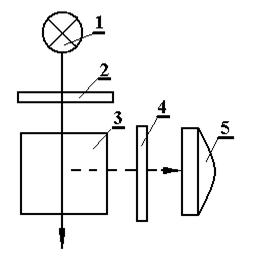
Рис. 1.22. Принципиальная оптическая схема флуориметра:
1– источник света; 2 – светофильтр; 3 – кювета;
4 – светофильтр; 5 – приемник света
1.5.4. Флуориметрическое определение бора в виде соединения с бензоином (работа № 8)
Цель работы: освоение флуориметрического метода; количест-венный анализ бора.
Сущность метода. Флуоресценция (разновидность люминесценции) представляет собой вторичное излучение молекул в короткий период времени непосредственно после поглощения инициирующего ультра-фиолетового излучения. Длина волны вторичного излучения больше, чем инициирующего. Для очень разбавленных растворов наблюдается линейная зависимость интенсивности флуоресценции от концентрации. Бор образует с бензоином комплекс, обладающий способностью к флуоресценции. При проведении реакции в щелочной водно-спиртовой среде облучаемый ультрафиолетовыми лучами раствор дает светло-голубое свечение с максимумом излучения около 480 нм.
Оборудование: 1) фотометр лабораторный ЛМФ-72 или ЛМФ-72 М; 2) колбы мерные на 25 см3 – 7 шт.; 3) пипетки градуированные на 5 см3 – 2 шт.; 4) пипетка на 15 см3 – 1 шт.; 5) бюретка на 50 см3 (для этанола); 6) стаканы на 100 см3 – 3 шт.; 7) стакан для слива на 300 см3.
Реактивы: 1) стандартный раствор бора, 20 мкг/см3 (в мерной колбе на 1000 см3 растворяют 0,112 г Н3ВО3 и доводят до метки 2%-ным раствором Na2CO3); 2) этанол (95%-ный); 3) буферный раствор с рН = 12,8 (в 50 см3 0,4%-ного раствора NaOH растворяют 0,375 г этиленгликоля; 0,30 г NaCl и 0,50 г NH4F и доводят дистиллированной водой до 500 см3); 4) 0,5%-ный раствор бензоина в 95%-ном этаноле.
Ход работы. В мерные колбы на 25 см3 помещают 1, 2, 3, 4 и 5 см3 стандартного раствора бора. Добавляют по 15 см3 этанола, 3 см3 буферного раствора, 2 см3 раствора бензоина и водой доводят объем до метки. Одновременно аналогично готовят задачу и нулевой раствор, содержащий все компоненты, кроме бора. Через 5 мин после сливания и перемешивания реагентов измеряют интенсивность флуоресценции эталонных растворов и задачи. По полученным данным строят калибровочный график в координатах «деления шкалы прибора – концентрация бора в пробе». Обрабатывают его по методу наименьших квадратов. Рассчитывают доверительный интервал для концентрации бора в пробе. Результат анализа определяют по графику.
Порядок флуориметрических измерений на приборе ЛМФ-72 М:
1. Включить прибор для прогрева в течение 0,5 ч (все кнопки отжаты).
2. Поворотный столик с кюветодержателем установить в положение 0.
3. В кюветодержатель поставить слева кювету с растворителем, справа с раствором максимальной концентрации (кюветы l = 2 см).
4. Нажать кнопку Ф (флуориметр).
5. Повернуть столик в положение И.
6. Ручками «0 грубо, точно» вывести стрелку на 0.
7. Повернуть столик в положение 100.
8. Ручками «100 грубо, точно» и вращением ручки диафрагмы вывести стрелку на 100. Если не удается вывести стрелку на 100, нажмите кнопку расширитель и повторите настройку.
9. Запишите показания прибора. Затем выньте кювету с раствором наибольшей концентрации. Смените раствор в кювете. Установите ее в кюветодержатель. Проведите измерение интенсивности флуоресценции для стандартных растворов и задачи.
Следите за чистотой поверхностей кювет и однообразностью их размещения в кюветодержателе.
Контрольные вопросы
1. Происхождение люминесценции. Природа явления. Классификация.
2. Закономерности флуоресценции (правило Стокса, правило зер-кальной симметрии).
3. Квантовый и энергетический выход. Закон Вавилова.
4. Факторы, влияющие на флуоресценцию. Зависимость интенсив-ности флуоресценции от концентрации раствора, температуры, рН.
5. Тушение флуоресценции ионами d -металлов. Применение этого явления для количественного анализа.
6. Принцип работы флуориметра и его основные узлы.
7. Методы измерения в люминесцентном анализе.
Литература
1. Турро, Н. Молекулярная фотохимия / Н. Турро. М.: Мир, 1967.
2. Борковский, В.Ф. Основы физико-химических методов анализа / В.Ф. Борковский В.Ф., Т.Б. Городенцова, Н.Б. Топорова. М.: Высшая школа, 1983.
 2015-01-30
2015-01-30 5423
5423
