Эквивалентом можно назвать реальную или условную частицу вещества, которая может замещать, присоединять или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Молярную массу эквивалента в большинстве обменных реакций (идущих без изменения степеней окисления участвующих в них элементов) можно рассчитать как отношение молярной массы вещества к числу рвущихся или образующихся связей в расчете на один атом или одну молекулу в ходе химической реакции.
Молярная масса эквивалента одного и того же вещества может быть различна в разных реакциях.
Молярную массу эквивалента в окислительно-восстановительных реакциях (идущих с изменением степеней окисления участвующих в них элементов) можно рассчитать как отношение молярной массы вещества к числу отданных или принятых электронов в расчете на один атом или одну молекулу в ходе химической реакции.
Для нахождения эквивалентной массы вещества в растворе пользуются простыми соотношениями:
Для кислоты HnAm:
Эк=M/n, где n – число ионов Н+ в кислоте. Например, эквивалентная масса соляной кислоты HCl находится: Эк =М/1, т.е. численно равна молярной массе; эквивалентная масса фосфорной кислоты Н3РО4 равна: Эк =М/3, т.е. в 3 раза меньше её молярной массы.
Для основания Kn(OH)m:
Эосн=М/m, где m – число гидроксид-онов ОН- в формуле основания. Например, эквивалентная масса гидроксида аммония NH4OH равна его молярной массе: Эосн =М/1; эквивалентная масса гидроксида меди (II) Cu(OH)2 в 2 раза меньше его молярной массы: Эосн =М/2.
Для соли KnAm:
Эс=М/(n×m), где n и m, соответственно, количество катионов и анионов соли. Например, эквивалентная масса сульфата алюминия Al2(SO4)3 равна: Эс =М/(2×3)=M/6.
Закон эквивалентов – на 1 эквивалент одного вещества в реакции приходится 1 эквивалент другого вещества.
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
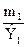 =
= 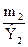
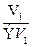 =
= 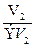
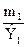 =
= 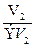
где m 1 и m 2 – массы реагентов и (или) продуктов реакции, г;
Э1, Э2 – молярные массы эквивалентов реагентов и (или) продуктов реакции, г/моль;
V 1, V 2 – объемы реагентов и (или) продуктов реакции, л;
ЭV1, ЭV2 – молярные объемы эквивалентов реагентов и (или) продуктов реакции, л/моль.
Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента (ЭV - объем, занимаемый молярной массой эквивалента или объем одного моль эквивалента). При н.у. ЭV(O2) = 5,6 л/моль, ЭV(Н2) = 11,2 л/моль,
Задача 1. На сгорание массы 12,4 г неизвестного элемента был израсходован объем 6,72 л кислорода. Рассчитайте эквивалент элемента и определите, какой элемент был взят в данной реакции.
По закону эквивалентов 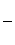
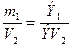
ЭV(O2) – эквивалентный объем кислорода, равный 5,6л
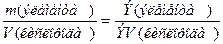
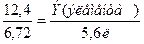
Э(элемента) = 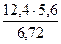 =10,3г/моль-экв
=10,3г/моль-экв
Для определения элемента необходимо найти его молярную массу. Валентность элемента (В), молярная масса (М) и эквивалент (Э) связаны соотношением  Э =
Э = 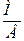 , отсюда М = Э∙В, (где В – валентность элемента).
, отсюда М = Э∙В, (где В – валентность элемента).
В данной задаче валентность элемента не указана, поэтому при решении необходимо использовать метод подбора, с учетом правил определения валентности – элемент, расположенный в нечетной (I, III, V, VII) группе таблицы Менделеева, может иметь валентность, равную любому нечетному числу, но не более номера группы; элемент, расположенный в четной (II, IV, VI, VIII) группе таблицы Менделеева, может иметь валентность, равную любому четному числу, но не более номера группы.
М = Э ∙ В = 10,3 ∙ I = 10,3 г/моль
Элемента с атомной массой 10,3 в таблице Менделеева нет, поэтому продолжаем подбор.
М = Э ∙ В = 10,3 ∙ II = 20,6 г/моль
Элемента с атомной массой 10,3 в таблице Менделеева нет, поэтому продолжаем подбор.
М = Э ∙ В = 10,3 ∙ III = 30,9 г/моль
Такая атомная масса у элемента № 15, этот элемент – фосфор (P).
(Фосфор расположен в V группе таблицы Менделеева, валентность этого элемента может быть равна III).
Ответ: элемент – фосфор (P).
Задача 2. На растворение 3,269 г неизвестного металла было израсходовано 5,6 г гидроксида калия. Рассчитайте эквивалент металла и определите, какой металл был взят для данной реакции.
По закону эквивалентов: 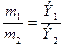
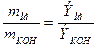
Эквивалент основания определяется как отношение его молярной массы к количеству групп ОН- в основании: М(КОН)=Аr(К)+ Аr(О)+ Аr(Н) =39+16+1 =56 г/моль
Э(КОН) = 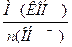 =
= 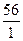 =56 г/моль
=56 г/моль
Эквивалент металла Э(Ме)= 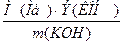 =
= 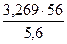 = 32,69 г/моль-экв
= 32,69 г/моль-экв
 В данной задаче валентность элемента не указана, поэтому при решении необходимо использовать метод подбора, с учетом правил определения валентности. Валентность всегда равна целым числам, М = Э ∙ В = 32,69 ∙ I = 32,69 г/моль
В данной задаче валентность элемента не указана, поэтому при решении необходимо использовать метод подбора, с учетом правил определения валентности. Валентность всегда равна целым числам, М = Э ∙ В = 32,69 ∙ I = 32,69 г/моль
Элемента с атомной массой 10,3 в таблице Менделеева нет, поэтому продолжаем подбор.
М = Э ∙ В = 32,69 ∙ II = 65,38 г/моль.
Такая молярная масса у элемента цинка (Zn).
Ответ: металл - цинк, Zn
Задача 3. Металл образует оксид, в котором массовая доля металла составляет 70%. Определите, какой металл входит в состав оксида.
Примем массу оксида, равной 100 г, тогда масса металла будет равна 70 г (т.е. 70% от 100г), а масса кислорода будет равна:
m(O)= m(оксида)-m(Ме) = 100 – 70 =30 г
Воспользуемся законом эквивалентов: 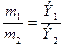
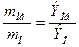 , где Э(О) = 8 г.
, где Э(О) = 8 г.
Э(Ме) = 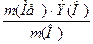 =
= 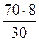 =18,67 г/моль-экв
=18,67 г/моль-экв
М (Ме) = Э ∙ В = 18,69 ∙ I = 18,69 г/моль
Элемента с такой молярной массой в таблице Менделеева нет, поэтому продолжаем подбор.
М = Э ∙ В = 18,69 ∙ II = 37,34 г/моль. Элемента с такой молярной массой в таблице Менделеева нет, поэтому продолжаем подбор.
М = Э ∙ В = 18,69 ∙ III = 56 г/моль.
Такая молярная масса у элемента Железо (Fe).
Ответ: металл - Железо (Fe).
Задача 4. Двухосновная кислота содержит 2,04% водорода, 32,65% серы и 65,31% кислорода. Определите валентность серы в этой кислоте.
Примем массу кислоты, равной 100 г, тогда масса водорода будет равна 2,04 г (т.е. 2,04 % от 100г), масса серы -32,65 г, масса кислорода - 65,31 г.
Находим эквивалент серы по кислороду, используя закон эквивалентов:
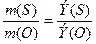 , где Э(О) = 8 г.
, где Э(О) = 8 г.
Э(S) = 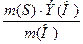 =
= 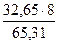 = 4 г/моль-экв
= 4 г/моль-экв
Валентность серы в том случае, если все атомы кислорода будут присоединены к сере, будет равна:
В = 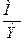 =
= 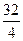 = 8, следовательно, атомы кислорода образуют в этой кислоте восемь химических связей. Кислота по условию – двухосновная, значит две связи, образуемые атомами кислорода, приходятся на соединение с двумя атомами водорода. Таким образом, из восьми связей кислорода на соединение с серой используется шесть связей, т.е. валентность серы в данной кислоте равна VI. Один атом кислорода образует две связи (валентности), поэтому количество атомов кислорода в кислоте можно рассчитать следующим образом:
= 8, следовательно, атомы кислорода образуют в этой кислоте восемь химических связей. Кислота по условию – двухосновная, значит две связи, образуемые атомами кислорода, приходятся на соединение с двумя атомами водорода. Таким образом, из восьми связей кислорода на соединение с серой используется шесть связей, т.е. валентность серы в данной кислоте равна VI. Один атом кислорода образует две связи (валентности), поэтому количество атомов кислорода в кислоте можно рассчитать следующим образом:
n(О) = 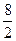 = 4.
= 4.
Соответственно, формула кислоты будет H2SO4.
Валентность серы в кислоте – VI, формула кислоты - H2SO4 (серная кислота).
 2015-01-30
2015-01-30 7333
7333
