Количество теплоты, необходимое для изменения температуры системы, пропорционально массе системы m и изменению температуры DТ.
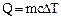 ,
,
где c- характеристика данного вещества, называемая удельной теплоемкостью (Дж/кгК)
Рассмотрим вопрос о количестве теплоты поставляемой идеальному газу при его нагревании или отбираемой при охлаждении.
Количество тепла, необходимое для изменения температуры газа, зависит от того, совершается ли при этом работа, т.е. изменяется ли при этом объем.
В случае газа, замкнутого в сосуде, объем которого не меняется, подводимое к нему тепло 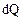 расходуется полностью на изменение его внутренней энергии
расходуется полностью на изменение его внутренней энергии  .
.
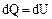 (2.2.1)
(2.2.1)
Если же газ находится в цилиндре изображенном на рис. 2.1.1, то он будет при нагревании расширяться, совершая работу и сохраняя при этом давление постоянным. Подводимое тепло рассчитывается из уравнения
 (2.2.2)
(2.2.2)
Отсюда следует, что при постоянном давлении выделяется (потребляется) большее количество теплоты.
Теплоемкостью тела называется количество тепла, которое необходимо подвести к нему или отнять от него для изменения его температуры на один градус.
Теплоемкость, относящаяся к единице массы вещества (кг), называется удельной теплоемкостью - с (Дж/кг·град).
Теплоемкость, относящаяся к одному молю вещества, называется молярной теплоемкостью - С (Дж/ град·моль).
Как удельная, так и молярная теплоемкости характеризуют не тело, а вещество, из которого оно состоит.
Удельная и молярная теплоемкости связаны соотношением
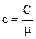 (2.2.3)
(2.2.3)
где 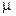 - молярная масса вещества.
- молярная масса вещества.
Для нагрева 1 моля вещества на dT градусов необходимо количество теплоты
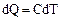 , т.е.
, т.е. 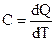 (2.2.4)
(2.2.4)
Молярная теплоемкость при постоянном объеме (изохорическая теплоемкость)
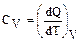 или согласно (2.2.1)
или согласно (2.2.1) 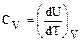 (2.2.5)
(2.2.5)
Следовательно, 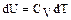 и уравнение (2.2.2) можно переписать в виде
и уравнение (2.2.2) можно переписать в виде
 (2.2.6)
(2.2.6)
Подводимое тепло расходуется на изменение температуры dT (изменение внутренней энергии) и изменение объема dV (совершение механической работы).
Теплоемкость при постоянном давлении Cp (изобарической теплоемкость)
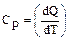
Для идеального одноатомного газа внутренняя энергия одного моля
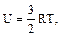 или
или  (2.2.7)
(2.2.7)
Разделим молярную теплоемкость на число молекул в одном моле вещества (число Авогадро) и получим «теплоемкость» отдельной молекулы газа
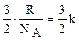
Таким образом, энергия каждой молекулы при увеличении температуры на один градус возрастает на 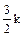 джоулей. Согласно (2.2.4), это строго соответствует изменению средней кинетической энергии молекулы.
джоулей. Согласно (2.2.4), это строго соответствует изменению средней кинетической энергии молекулы.
Теплоемкость Cp идеального газа при постоянном давлении больше теплоемкости CV при постоянном объеме на величину работы 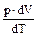 расширяющегося газа при нагревании на один градус.
расширяющегося газа при нагревании на один градус.
Следовательно,
 .
.
Поскольку для одного моля
 , то
, то 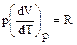 и
и
 (2.2.8)
(2.2.8)
Адиабатный процесс характеризуется изменением объема газа при условии термодинамической изоляции системы, так что 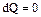 , а
, а 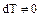 , следовательно, на основании 2.1.4
, следовательно, на основании 2.1.4
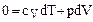 и
и  .
.
Отсюда 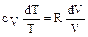 или, согласно 2.2.1,
или, согласно 2.2.1,
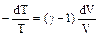 ,
,
где  - показатель адиабаты.
- показатель адиабаты.
После интегрирования, в границах от V1 при T1 до V2 при T2, получим
 .
.
Отсюда
 (2.2.9)
(2.2.9)
или 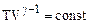 .
.
После подстановки в это выражение 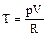 получим уравнение адиабаты:
получим уравнение адиабаты:
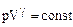 (2.2.10)
(2.2.10)
Работа адиабатического расширения газа против внешних и внутренних сил 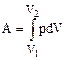 .
.
Так как 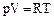 , следовательно,
, следовательно,  и
и
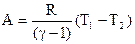 , (2.2.11)
, (2.2.11)
т.е. работа определяется значением разности температур в начале и конце процесса.
На рисунке 2.2.1 представлены графики зависимости p=f(V) для четырех основных процессов в газе при одинаковых исходных значениях p и V. Всю совокупность термодинамических процессов в газах можно представить одним уравнением политропы вида
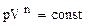 , (2.2.12)
, (2.2.12)
где n изменяется в пределах от 0 до ∞: n=1 для изотермы, n=γ для адиабаты, n=0 для изобары и n=∞ для изохоры.
Теплоемкость связана с числом степеней свободы i.
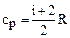 ,
,  ,
, 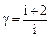 (2.2.13)
(2.2.13)
Постоянная R=8,31 Дж/град·моль. Отсюда для идеального газа CV=12,5Дж/град·моль, Cp=20,8 Дж/град·моль, а их отношение Cp/CV=g=1,66 Дж/кг·моль (показатель адиабаты). Сравнение расчетных данных с экспериментальными значениями для одноатомных газов (таблица 2.2.1) дает хорошее соответствие.
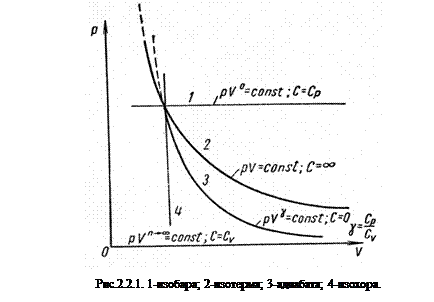
Таблица 2.2.1. Теплоемкости одноатомных газов.
| Газ | Cv/R | (Cp-Cv)R | Cp/CV |
| Гелий | 1,519 | 1,001 | 1,659 |
| Неон | 1,64 | ||
| Аргон | 1,5 | 1,008 | 1,67 |
| Криптон | 1,68 | ||
| Ксенон | 1,66 |
Это обусловлено тем, что модели идеального газа молекул в виде материальных точек более всего отвечают одноатомные газы.
Для двух и более атомных молекул необходимо учитывать дополнительные степени свободы (вращательные и колебательные). Как было отмечено ранее (2.1.5), средняя энергия молекулы
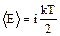
Отсюда внутренняя энергия моля газа
 (2.2.14)
(2.2.14)
а молярные теплоемкости газа
 (2.2.15)
(2.2.15)
 (2.2.16)
(2.2.16)
Приведенная модель равномерного распределения энергии по степеням свободы (закона равнораспределения) позволяет объяснить экспериментальные данные для ряда двухатомных молекул. Однако теплоемкости трехатомных газов оказываются больше расчетного значения. Существенным противоречием теории и эксперимента является то, что теплоемкость оказывается зависящей от температуры (с понижением температуры уменьшается). Теоретически должна быть постоянной. Объяснить это изменением числа степеней свободы с изменениями температуры неправомерно, ибо тогда теплоемкость должна изменяться скачками. Это позволяет заключить, что классический закон равномерного распределения энергии по степеням свободы не полностью отвечает действительности.
Пример 11. Давление идеального одноатомного газа уменьшилось в два раза по сравнению с начальным значением. Во сколько раз изменится объем газа, если процесс:
1) адиабатический, 2) изотермический.
Решение. Из уравнения адиабаты 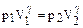

имеем 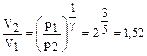
При изотермическом процессе по закону Бойля-Мариотта
 . Следовательно,
. Следовательно, 
 2015-01-30
2015-01-30 6988
6988
