Цель: Изучить реакции, протекающие в растворах с участием электролитов, закрепить умения написания реакций в молекулярно-ионном виде, выяснить условия протекания реакций в растворах до конца.
Теоретическая часть
Растворы электролитов проводят электрический ток. Проводниками электрического тока являются катионы и анионы, образующиеся в растворе в результате электролитической диссоциации растворенных веществ.
Для количественной характеристики электролитической диссоциации введено понятие степени диссоциации.
Степень диссоциации ( α) – это отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворенного электролита:
α = 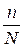
По степени диссоциации в растворах все электролиты делятся на 2 группы: сильные и слабые.
Слабые электролиты.
Электролиты, степень диссоциации которых в растворах имеет значение меньше 0,3 (30%) и уменьшается с ростом концентрации, называют слабыми электролитами. К ним относят воду, органические кислоты и основания, ряд неорганических кислот (угольная, сернистая, синильная и др.), ограниченно растворимые в воде основания, малорастворимые соли.
В растворах слабых электролитов процесс диссоциации протекает обратимо, следовательно, к нему может быть применен закон действующих масс. Так, для процесса диссоциации кислоты
НА 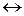 Н+ + А- константа равновесия Кс равна
Н+ + А- константа равновесия Кс равна
Кс = Кд = 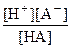
Константа диссоциации (Кд) зависит от природы диссоциирующего вещества и растворителя, а также от температуры и не зависит от концентрации раствора.
Степень диссоциации α изменяется с концентрацией раствора. Если принять исходную концентрацию кислоты равной С, а степень диссоциации α, то зависимость между степенью диссоциации, константой диссоциации и концентрацией для слабых электролитов имеет вид:
α = 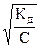
Это уравнение называется законом разбавления Оствальда. Из него следует, что степень диссоциации уменьшается с увеличением концентрации слабого электролита.
Многоосновные слабые кислоты и многокислотные слабые основания диссоциируют ступенчато, причем константа диссоциации по каждой последующей ступени, всегда на несколько порядков ниже, чем по предыдущей.
Ионные реакции в растворах
В растворах электролитов присутствуют ионы, подвижность которых выше, чем недиссоциированных молекул. Кроме того, большинство ионов обладают высокой реакционной способностью. Поэтому химические реакции в растворах протекают с высокими скоростями, и химическое равновесие устанавливается быстро.
Химические свойства раствора электролита складываются из свойств образующих его ионов. Группа электролитов, содержащая один и тот же вид ионов, обладает сходными химическими свойствами.
Основным фактором, влияющим на смещение равновесия в растворах электролитов, является изменение концентрации ионов. Поэтому обменные реакции в растворах идут в сторону образования малорастворимых веществ или слабых электролитов. Малорастворимые вещества могут выводиться из раствора в виде осадка или газа.
Опыт 1. В одну пробирку поместите 2 капли раствора ацетата натрия, в другую – столько же раствора хлорида аммония. В первую прибавьте 2-3 капли фосфорной кислоты, во вторую- 2-3 раствора щелочи. Испытайте на запах обе пробирки. Напишите молекулярные и ионные уравнения реакций.
Опыт 2. Поместите в две пробирки по 3 капли растворов: в одну сульфата меди (II), в другую сульфата никеля (II). Затем в каждую из пробирок прибавить по 3 капли раствора ортофосфата натрия. Отметьте цвет образовавшихся осадков и напишите молекулярно-ионные уравнения реакций.
Опыт 3. Поместите отдельно в пробирки твердые карбонаты натрия, калия, кальция, гидрокарбонат натрия и добавьте в каждую по 5-6 капель раствора фосфорной кислоты. Между какими ионами протекает реакция? Напишите ионные уравнения реакций
.
Опыт 4. Поместите в две пробирки по 2-3 капли раствора аммиака и добавьте по одной капле раствора фенолфталеина. В одну пробирку внесите микрошпателем несколько кристаллов соли хлорида аммония и хорошо взболтайте. Объясните изменение окраски раствора при введении соли хлорида аммония. Напишите уравнение диссоциации гидроксида аммония и константу диссоциации. Что надо добавить к раствору слабого основания, чтобы сместить равновесие в сторону образования малодиссоциированных молекул?
Контрольные вопросы
1) Что такое электролитическая диссоциация?
2) В каких пределах изменяется степень электролитической диссоциации?
3) Что такое константа диссоциации и что она характеризует?
4) Какие вещества называют электролитами?
5) Какие электролиты относят к сильным? А какие к слабым? Привести примеры.
6) В каком случае реакции в растворах электролитов проходят полностью?
7) Определить степень диссоциации уксусной кислоты в 0,2н растворе.
8) Константа диссоциации бинарного слабого электролита равна 0,0001. При какой концентрации степень диссоциации этого электролита достигнет 10%?
9) Смешаны растворы веществ: а) карбоната натрия и хлорида бария; б) сульфата железа (П) и сульфида аммония. Составьте молекулярные и ионные уравнения реакций взаимодействия этих веществ.
9 ЛАБОРАТОРНАЯ РАБОТА № 9. КОЛЛОИДНЫЕ РАСТВОРЫ
Цель: Получить коллоидные растворы, исследовать их коагуляцию под действием электролита, изучить эффект Тиндаля.
Теоретическая часть
Коллоидные системы относятся к дисперсным системам – системам, где одно вещество в виде частиц различной величины распределено в другом. Дисперсные системы чрезвычайно многообразны; практически всякая реальная система является дисперсной. Дисперсные системы классифицируют, прежде всего, по размеру частиц дисперсной фазы (или степени дисперсности); кроме того, их разделяют на группы, различающиеся по природе и агрегатному состоянию дисперсной фазы и дисперсионной среды.
По степени дисперсности выделяют обычно следующие классы дисперсных систем:
Грубодисперсные системы – системы, размер частиц дисперсной фазы в которых превышает 10-7 м.
Коллоидные системы – системы, размер частиц дисперсной фазы в которых составляет 10-7 – 10-9 м. Коллоидные системы характеризуются гетерогенностью, т.е. наличием поверхностей раздела фаз и очень большим значением удельной поверхности дисперсной фазы. Это обусловливает значительный вклад поверхностной фазы в состояние системы и приводит к появлению у коллоидных систем особых, присущих только им, свойств.
Коллоидные системы по степени дисперсности занимают промежуточное положение между истинными растворами (молекулярно- или ионно-дисперсными системами) и грубодисперсными системами. Поэтому коллоидные растворы могут быть получены либо путем ассоциации (конденсации) молекул и ионов истинных растворов, либо дальнейшим раздроблением частиц дисперсной фазы грубодисперсных систем.
Методы получения коллоидных растворов также можно разделить на две группы: методы конденсации и диспергирования. Еще одним необходимым для получения золей условием, помимо доведения размеров частиц до коллоидных, является наличие в системе стабилизаторов – веществ, препятствующих процессу самопроизвольного укрупнения коллоидных частиц.
Строение коллоидной мицеллы.
Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются, поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения степени дисперсности дисперсной фазы (т.е. объединение частиц в более крупные агрегаты) – коагуляцию золей. Тем не менее, золям присуща способность, сохранять степень дисперсности – агрегативная устойчивость, которая обусловлена, во-первых, снижением поверхностной энергии системы благодаря наличию на поверхности частиц дисперсной фазы двойного электрического слоя и, во-вторых, наличием кинетических препятствий для коагуляции в виде электростатического отталкивания частиц дисперсной фазы, имеющих одноименный электрический заряд.
Строение структурной единицы лиофобных коллоидов – мицеллы – может быть показано лишь схематически, поскольку мицелла не имеет определенного состава. Рассмотрим строение коллоидной мицеллы на примере гидрозоля иодида серебра, получаемого взаимодействием разбавленных растворов нитрата серебра и иодида калия:
AgNO3 + KI → AgI + KNO3
Коллоидная мицелла золя иодида серебра образована микрокристаллом иодида серебра, который способен к избирательной адсорбции из окружающей среды катионов Ag+ или иодид-ионов. Если реакция проводится в избытке иодида калия, то ядро будет адсорбировать иодид-ионы; при избытке нитрата серебра микрокристалл адсорбирует ионы Ag+. В результате этого микрокристалл приобретает отрицательный, либо положительный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими, а сам заряженный кристалл – ядром мицеллы. Заряженное ядро притягивает из раствора ионы с противоположным зарядом – противоионы; на поверхности раздела фаз образуется двойной электрический слой. Некоторая часть противоионов адсорбируется на поверхности ядра, образуя адсорбционныйслой противоионов; ядро вместе с адсорбированными на нем противоионами называют коллоидной частицей или гранулой. Остальные противоионы, число которых определяется, исходя из правила электронейтральности мицеллы, составляют диффузный слой противоионов; противоионы адсорбционного и диффузного слоев находятся в состоянии динамического равновесия адсорбции – десорбции.
Схематически мицелла золя иодида серебра, полученного в избытке иодида калия (потенциалопределяющие ионы – анионы I–, противоионы – ионы К +) может быть изображена следующим образом:
{[AgI]m · nI– · (n-x)K+}x– · x K+
При получении золя иодида серебра в избытке нитрата серебра коллоидные частицы будут иметь положительный заряд:
{[AgI]m · nAg+ · (n-x)NO3–}x+ · x NO3–
Опыт 1. Получение золя гидроксида железа (III).
Приготовьте 50 мл кипящей дистиллированной воды и влейте в нее 3-5 мл 2% раствора FeCl3. Получается коллоидный раствор красно-коричневого цвета. Исследуйте раствор на наличие эффекта Тиндаля.
Напишите уравнение реакции гидролиза FeCl3 и строение мицеллы золя Fe(ОН)3.
Укажите способы получения данных золей. Полученный золь сохраните для опыта №2,4.
Опыт 2. В три цилиндрические пробирки возьмите по 1 мл коллоидного раствора гидроксида железа, приготовленного в опыте 1. Затем в каждую пробирку прибавьте по каплям до появления мути или осадка следующие растворы солей: в первую пробирку NaCl, во вторую Na2SO4 и в третью Na3PO4.
В какой пробирке коагуляция протекает быстрее? Почему?
Опыт 3. Изменение знака заряда коллоида в зависимости от способа получения.
Возьмите 1 мл 0,01н раствора азотнокислого серебра и добавьте из пипетки по каплям 0,1 мл 0,01н раствора иодида калия. Образуется золь с положительно заряженными частицами. В другую пробирку налейте 1 мл раствора иодида калия и добавьте по каплям из пипетки 0,1 мл 0,01н раствора азотнокислого серебра. Образуется золь с отрицательно заряженными частицами. Определите заряд коллоидной частицы методом капиллярного анализа. Он основан на том, что целлюлозные стенки капилляров фильтровальной бумаги заряжаются отрицательно, а пропитывающая бумагу вода - положительно. Нанесите на листок фильтровальной бумаги каплю исследуемого золя. Опишите результаты наблюдений и объясните их.
Опыт 4. Диализ золя гидроксида железа (III).
Возьмите золь, полученный в опыте № 1, и налейте его в полиэтиленовый мешочек. Затем опустите этот мешочек на 2/3 в стакан с дистиллированной водой; воду периодически меняйте до тех пор, пока в отдельно взятой порции воды ионы хлора будут обнаруживаться лишь по слабому помутнению раствора от прибавления нескольких капель раствора нитрата серебра.
Контрольные вопросы
1) На какие группы делятся все методы получения золей. Что является основанием для такого деления?
2) Назовите необходимые условия для получения коллоидных систем по любому из методов синтеза.
3) На чем основаны конденсационные методы получения золей?
4) Для чего применяют диализ? Объяснить принцип работы диализатора.
5) Чем строение мицеллы отличается от строения коллоидной частице?
10 ЛАБОРАТОРНАЯ РАБОТА № 10. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ И ГИДРОЛИЗ СОЛЕЙ
Цель: Научиться определять реакцию среды растворов с помощью различных индикаторов. Изучить механизм реакции гидролиза солей.
Теоретическая часть
В чистой воде часть молекул воды диссоциирует на ионы:
Н2О ↔ Н+ + ОН-
Измерено, что при комнатной температуре концентрации Н+ и ОН¯ равны 10-7 моль/л. Произведение концентрации Н+ и ОН¯ называют ионным произведением воды и численно равно 10-14 и его можно записать так: К 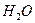 = [Н+ ][ОН-]
= [Н+ ][ОН-]
Растворы, в которых концентрация ионов водорода и гидроксид-ионов  одинаковы, называют нейтральными растворами. Вместо значения концентрации ионов водорода часто пользуются ее десятичным логарифмом, взятым с обратным знаком, и эта величина называется водородным показателем: рН = - lg
одинаковы, называют нейтральными растворами. Вместо значения концентрации ионов водорода часто пользуются ее десятичным логарифмом, взятым с обратным знаком, и эта величина называется водородным показателем: рН = - lg 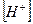 . В нейтральной среде рН = 7, в кислой среде рН < 7, в щелочной среде рН > 7. Для приблизительного определения рН пользуются индикаторами, т.е. веществами, меняющими свою окраску в зависимости от щелочности или кислотности среды.
. В нейтральной среде рН = 7, в кислой среде рН < 7, в щелочной среде рН > 7. Для приблизительного определения рН пользуются индикаторами, т.е. веществами, меняющими свою окраску в зависимости от щелочности или кислотности среды.
Гидролизом соли называется взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды, сопровождающееся изменением концентрации ионов Н+ или ОН¯ в растворе.
Возможны следующие случаи гидролиза:
1) Соль, образованная сильным основанием и слабой кислотой.
В результате гидролиза такой соли реакция раствора щелочная, т.к. происходит связывание ионов Н+ воды с ионами кислотного остатка в слабодиссоциирующую кислоту и накопление в растворе ионов ОН¯, образующихся в результате образования в растворе сильной щелочи, которая полностью диссоциирует на ионы:
Na2CO3 + H2O ↔ NaHCO3 + NaOH
Или в ионно-молекулярной форме:
СО32ˉ + Н2О ↔ НСО3¯ + ОН¯
2) Соль, образованная слабым основанием и сильной кислотой.
Здесь в случае гидролиза соли реакция среды кислая, т.к. ионы ОН- воды связываются в слабодиссоциирующие основания, а ионы Н+ накапливаются в растворе:
CuCl2 + H2O ↔ CuOHCl + HCl
или в ионно-молекулярной форме:
Сu2+ + H2O ↔ CuOH+ + H+
3) Соль, образованная слабой кислотой и слабым основанием.
Это случай полного гидролиза соли. Реакция среды зависит от относительной силы кислоты или основания. Если константа диссоциации кислоты больше константы диссоциации основания, то раствор имеет слабокислую реакцию, при обратном соотношении констант диссоциации – слабощелочную:
NH4CH3COO + H2O ↔ NH4OH + CH3COOH
NH4+ + CH3COOˉ + H2O ↔ NH4OH + CH3COOH
4) Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются.
Количественно гидролиз соли оценивается степенью гидролиза. Степень гидролиза – это отношение числа молекул, подвергшихся гидролизу, к общему числу растворенных молекул.
Опыт 1. Гидролиз солей.
В 6 пронумерованных пробирок налейте по 2 мл дистиллированной воды и добавьте по несколько капель нейтрального лакмуса. Внесите в пробирки порознь по несколько кристалликов следующих солей: 1 – карбонат калия, 2 – фосфат натрия, 3 – хлорид алюминия, 4 – ацетат аммония, 5 – хлорид натрия. Перемешайте растворы и сравните их окраску с окраской раствора в чистой пробирке, рассматривая их на фоне белой бумаги. Результаты опытов занесите в таблицу 5:
Таблица 5 – Результаты опыта 1
| № | Формула вещества | Цвет лакмуса | Реакция среды | рН > 7 рН < 7 | Подвергается ли соль гидролизу |
Составьте ионные и молекулярные уравнения гидролиза солей и укажите случай гидролиза каждой соли (простой или ступенчатый). В случае ступенчатого гидролиза напишите уравнение реакции только для первой ступени, т.к. практически в достаточно концентрированных растворах последующие ступени протекают очень слабо.
Опыт 2. Влияние температуры на степень гидролиза.
Налейте в 2 пробирки раствор хлорида железа. Одну пробирку оставьте для сравнения. Раствор в другой пробирке доведите до кипения. Объясните выпадение осадка. Напишите уравнение реакции гидролиза. Какую роль играет нагревание раствора?
Опыт 3. Полный гидролиз (необратимый).
К 1-2 мл раствора сульфата алюминия прилейте такой же объем раствора соды Nа2СО3. Наблюдайте выделение СО2 и образование осадка гидроксида алюминия. Проверьте, что выпавший осадок именно гидроксид алюминия, используя свойство амфотерности гидроксида алюминия. Напишите молекулярное и ионное уравнения реакции совместного гидролиза взятых солей.
Опыт 4. Растворение цинка в продукте гидролиза хлорида цинка.
Налейте в пробирку 3-4 мл хлорида цинка. Испытайте реакцию среды лакмусом. В раствор опустите кусочек цинка и нагрейте. Наблюдайте выделение пузырьков водорода. Составьте ионное и молекулярное уравнения гидролиза хлорида цинка и взаимодействия цинка с одним из продуктов гидролиза.
Контрольные вопросы
1) Какими индикаторами определяется кислая, щелочная и нейтральная среда?
2) Какой индикатор называется универсальным?
3) Какие соли подвергаются гидролизу?
4) Как влияет повышение температуры на протекание гидролиза?
5) В каких случаях гидролиз соли является процессом необратимым?
11 ЛАБОРАТОРНАЯ РАБОТА № 11. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ И ИХ СОЕДИНЕНИЙ
Цель: Провести реакции, подтверждающие химические свойства металлов и их важнейших соединений, составить уравнения проведенных реакций в молекулярном и ионном виде.
Теоретическая часть
Большинство элементов периодической системы Д. И. Менделеева – металлы. Общей особенностью атомов металлов является содержание на их внешнем электронном уровне небольшого числа электронов (1, 2,3) и бóльшие размеры атомов металлов по сравнению с неметаллами. Внешние электроны в атомах металлов находятся на значительном удалении от ядра и связаны с ним сравнительно слабо, вследствие чего атомы металлов характеризуются малым значением энергии ионизации (потенциала ионизации). Металлы сравнительно легко отдают валентные электроны, образуя положительно заряженные ионы. Таким образом, металлы в своих соединениях проявляют только положительную степень окисления. Многие металлы (главным образом р- и d-элементы), например хром, марганец, проявляют переменную положительную степень окисления. В связи с этим металлы в свободном состоянии являются восстановителями. Для реакций в водных растворах восстановительная активность металлов определяется положением металла в ряду напряжений металлов и концентрацией его ионов в растворе.
1) Свойство типичных металлов – способность реагировать с водой и кислотами. При этом электроны металлов переходят к ионам водорода, образующимся при диссоциации кислоты или воды. В результате образуется молекулярный водород. При действии на металл разбавленных соляной и серной кислот продуктом восстановления является молекулярный водород. При действии концентрированной серной кислоты выделяются продукты восстановления серы: сероводород, сера или двуокись серы. Азотная кислота любой концентрации является сильным окислителем за счет присутствия в ней азота в высшей степени окисления (5+). Продукты восстановления зависят от концентрации кислоты и активности металла (двуокись азота, окись азота и даже аммиак, который в избытке кислоты образует соль – аммоний азотнокислый).
Внутри периода слева направо связь валентных электронов с ядром усиливается вследствие увеличения заряда ядра, поэтому металлические свойства постепенно ослабевают. При переходе к новому периоду они резко усиливаются, т.к. электроны нового уровня расположены гораздо дальше от ядра, а заряд ядра при этом увеличивается слишком мало. В силу этого возникает неодинаковость притяжения электронов к ионам, что делает возможным переход электронов от одного металла к другому при прямом контакте различных металлов.
2) На некоторые металлы (цинк, алюминий, олово, свинец, хром) действуют растворы щелочей, в результате чего получаются соли очень слабых кислот (цинковой, алюминиевой и др.) с выделением свободного водорода – это результат взаимодействия атомов металла с ионами водорода воды, а не водорода, входящего в состав щелочи, например:
Zn + 2H2O = Zn(OH)2 + H2↑
В отсутствии щелочи образующийся гидроксид цинка, как трудно растворимое соединение, покрывает поверхность металла и процесс прекращается. По этой причине вышеуказанные металлы не растворяются в воде. Роль щелочи заключается в растворении гидроксида металла:
Zn(OH)2 + 2NaOH = Na2 [Zn(OН)4 ]+ 2H2O
Суммарное уравнение реакций:
Zn + 2NaOH+ 2Н2О = Na2 [Zn(OН)4 ] + H2↑
3) Оксиды большинства металлов с постоянной степенью окисления имеют основной характер (оксиды калия, кальция, магния и т.п.) Некоторые металлы с постоянной степенью окисления (цинк, алюминий, бериллий) образуют амфотерные оксиды, которые ведут себя по отношению к кислотам как основные оксиды, а по отношению к щелочам – как кислотные:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 2NaOH = 2Na[Al(OН)4 ] + H2O
Металлы, обладающие переменной степенью окисления, образуют несколько оксидов, характер которых зависит от степени окисления: низшие оксиды имеют основной характер; средние – амфотерный, а высшие в большинстве случаев проявляют кислотные свойства.
Например: CrO - основной, Cr2O3 – амфотерный, CrO3 - кислотный.
Гидроксиды могут быть основными, кислотными, амфотерными. Кислотным оксидам металлов соответствуют гидроксиды кислотного характера: CrO3: Н2СrO4 - хромовая кислота; H2Cr2O7 - двухромовая кислота; Мn2O7  HMnO4 - марганцевая кислота
HMnO4 - марганцевая кислота
Существуют гидроксиды, которые диссоциируют с образованием и ионов водорода и ионов гидроксила. Такие гидроксиды называются амфотерными. На практике характеры оксидов и гидроксидов устанавливаются по их отношению к кислотам и щелочам. Кислотные гидроксиды растворяются в щелочах, основные гидроксиды растворяются в кислотах. Амфотерные гидроксиды растворяются и в кислотах и в щелочах.
Опыт 1. Действие разбавленной фосфорной кислоты на металлы
В 4 пробирки налейте 2-3 мл раствора фосфорной кислоты. В одну пробирку опустите кусочек цинка, в другую – железо, в третью – алюминий, в четвертую – медь. Если реакция не идет, нагреть на водяной бане. Какие металлы будут реагировать с кислотой? Составьте уравнения реакций, отметьте окислитель и восстановитель. Напишите уравнения реакций взаимодействия концентрированной серной кислоты с железом, учитывая, что железо приобретает высшую степень окисления (3+), а сера восстанавливается минимально (4+). Составьте электронные уравнения. Напишите уравнения реакций азотной кислоты (концентрированной и разбавленной) с медью. Составьте электронные уравнения.
Опыт 2. Действие щелочи на металлы.
В две пробирки налейте по 2 мл 30% раствора щелочи (раствор в вытяжном шкафу!). В одну пробирку бросьте кусочек цинка, в другую – алюминия. Если реакция не идет, слегка подогрейте. Когда начнется энергичное выделение газа, поднесите к отверстиям пробирок зажженную спичку или лучину, что наблюдается? Составьте уравнения реакций, имея в виду, что образуются гидроксокомплексы алюминия и цинка.
Опыт 3. Получение гидроксидов.
В 4 пробирки налейте порознь по 2-3 мл растворов солей цинка, меди, алюминия и марганца. В каждую пробирку добавьте по каплям раствор щелочи до образования осадков. Осадки сохраните для следующего опыта. Напишите ионные и молекулярные уравнения происходящих реакций.
Опыт 4. Установление характера гидроксида.
Каждый из осадков, полученный в опыте 3, разделить на 2 части и на одну часть подействовать азотной кислотой, а на другую – раствором щелочи. Растворение гидроксидов в кислотах и щелочах выразить молекулярными и ионными уравнениями. Сделайте вывод о характере гидроксидов и запишите в таблицу 6:
Таблица 6 - Результаты опыта 4
| № п/п | Формулы взятых солей | Формулы получен- ных гид-роксидов. | Раствори-мость гидроксидов в кислотах | Растворимость гидроксидов в щелочах | Заключение о характере гидроксида |
Составьте уравнения реакций в молекулярном и ионном виде.
 2015-01-30
2015-01-30 11610
11610
