Гидролизом солей называют реакции обмена между водой и растворенными в ней солями. В результате протекания процесса гидролиза соли растворе появляется некоторое избыточное количество ионов H+ и OH¯, сообщающее раствору кислотные или щелочные свойства. Таким образом, процесс гидролиза соли во многом обратен процессу нейтрализации, т.е. процессу взаимодействия кислот с основаниями. Гидролизу не подвергаются соли, образованные сильными кислотами и основаниями, например KCl.
Гидролиз солей – обратимая или необратимая реакция солей с водой.
1. если соль образована сильным основанием и слабой кислотой НА, то в водном растворе она диссоциирует с образованием ионов кислотного остатка А-,, которые стремятся забрать протоны у воды: А- +H2O ↔ НА + ОН-.
Константа гидролиза выражается через ионное произведение воды и константу диссоциации кислоты: концентрации продукты реакции делятся на исходное вещество.
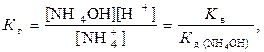
Количественно гидролиз как равновесие характеризуется степенью гидролиза и константой гидролиза. Степень гидролиза измеряется отношением количества гидролизованного вещества к общему количеству растворенного вещества.
|
|
|
Степень гидролиза зависит от природы соли, ее концентрации и температуры. Согласно закону действующих масс степень гидролиза возрастает с разбавлением раствора. Так, при концентрации Na2CО3 0,001 моль/л степень гидролиза составляет 34%.
В общем случае справедливы следующие закономерности.
1. Гидролиз соли должен усиливаться с повышением температуры и разбавлением раствора.
2. При обратимом гидролизе в соответствии с принципом Ле Шателье процесс должен подавляться при подкислении (если эта соль образована сильной кислотой и слабым основанием, накапливаются ионы Н) или при подщелачивании (если соль образована слабой кислотой и сильным основанием, накапливаются ионы ОН).
3. Гидролиз солей, в результате которого образуются малорастворимые или газообразные продукты, удаляю щиеся из сферы реакции (принцип смещения равновесия), необратим. Например, гидролиз Pb(SО4)2 протекает полностью вследствие образования осадка PbO2:
Pb(SО4)2 + 2Н2О → PbO2 + 2H2SО4.
 2015-01-30
2015-01-30 6129
6129
