Укажите номер правильного ответа:
1. Главное квантовое число (n) характеризует:
1) Вращение А.О. вокруг собственной оси;
2) Энергию электрона (номер Э.У.);
3) Форму А.О. (подуровень);
4) Расположение А.О. в магнитных осях атома.
2. Если n = 1, то l принимает значения:
1) О (s), 1(p);
2) O (s);
3) O (s), 1 (p), 2 (d);
4) O (s), 1 (p), 2 (d,) 3 (f)
3. После 5 s – подуровня, согласно правилу Клечковского заполняется подуровень:
1) 4 p 3) 3 p
2) 3 d 4) 4 d
5. Электронная формула 4 s23 d6 соответствует атому:
1) Mn 3) Fe
2) Co 4) Ni
6. Две свободные 3 d – А.О. имеет атом:
1) V 3) Sc
2) Ti 4) Fe
7. Атому Fe в возбужденном состоянии соответствует электронная формула:
1) 4 s14 p1 3) 3 d54 s14 p1
2) 3 d54 s1 4) 3 d64 s14 p1
8. Электронная формула иона Э2+ _________ 4 s03 d8 соответствует атому:
1) Sc 3) Mn
2) Fe 4) Ni
9. Явление провала (проскока) электронов у элементов IV n. наблюдаются:
1) Zn и Mn 3) Cr и Cu
2) Co и Ni 4) V и Ti
10. Высшая степень окисления атома элемента с электронной формулой 4 s23 d5 равна:
1) (+6) 2) (+7) 3) (+5) 4) (+4)
11. Низшая степень окисления атома азота равна:
1) (-1) 2) (-3) 3) (-2) 4) (0)
Дополните:
12. Ковалентная связь – это связь за счет ______ образуется между атомами элементов ________
13. Связь, образованная по линии, связывающей ядра атомов называется ______ связью, эта связь имеет особенности: 1 __________
2__________
3 __________
14. Число 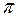 связей в молекуле SO2Cl2 равно _________
связей в молекуле SO2Cl2 равно _________
Укажите номер правильного ответа:
15. Вещества с ковалентной полярной связью – это:
1) фтор 2) алмаз 3) кобальт 4) аммиак
16. Полярность ковалентной связи уменьшается в ряду:
1) HBr, HCl, HJ
2) CO2, CCL4, CF4
3) NH3, PH3, AsH3
4) SеO2, TeO2, SO2
17. Химическая связь в молекулах аммиака и брома соответственно:
1) Ковалентная полярная и ковалентная неполярная
2) Ионная и ковалентная полярная
3) Ковалентная неполярная и ковалентная полярная
4) Водородная и ковалентная неполярная
18. К гомогенной реакции относится:
1) С + О2 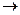 СО2
СО2
2) S + O2 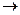 SO2
SO2
3) N2 + O2 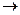 2NO
2NO
4) 2Al + 3Cl3 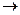 2AlCl3
2AlCl3
19. Математическое выражение средней скорости химической реакции
mA + nB 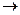 gC имеет вид:
gC имеет вид:
1) 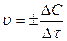 2)
2) 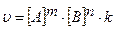 3)
3) 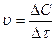 4)
4) 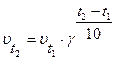
20. При увеличении концентрации SO2 в 4 раза скорость реакции
2SO2 + O2 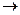 2SO3 увеличится в:
2SO3 увеличится в:
1) 32 раза 2) 16 раз 3) 8 раз 4) 4 раза
21. При повышении давления в 3 раза скорость реакции 2NO + O2 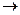 2NO2 возрастет в:
2NO2 возрастет в:
1) 27 раз 2) 9 раз 3) 8 раз 4) 6 раз
22. С повышением температуры (to 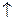 ) химическое равновесие
) химическое равновесие
CO + H2O 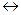 CO2 + H2 (-
CO2 + H2 (- 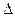 H) сместиться:
H) сместиться:
1) вправо 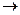
2) влево 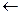
23. Если повысить давление, то химическое равновесие H2 + Cl2 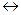 2HCl сместиться:
2HCl сместиться:
1) вправо 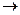
2) влево 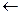
3) равновесие не сместится
24. Оптимальные условия синтеза оксида серы (VI)
2SO2 + O2 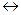 2SO3 (-
2SO3 (- 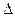 Hx.p.):
Hx.p.):
1) P 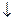 , to
, to 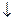 3) P
3) P 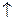 , to
, to 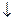
2) P 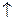 , to
, to 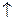 4) P
4) P 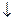 , to
, to 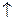
25. Математическое выражение Кр системы nA + mB 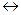 gC + pD имеет вид:
gC + pD имеет вид:
1) 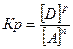 ; 3)
; 3) 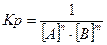 ; г г
; г г
2) 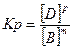 ; 4)
; 4) 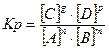 .
.
26. Равновесие химической реакции 4HCl + O2 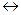 2Cl2 + 2H2O (-
2Cl2 + 2H2O (- 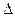 H) смещается в сторону продуктов при г г г г
H) смещается в сторону продуктов при г г г г
1) повышении температуры
2) повышении давления
3) наличие катализатора
4) понижении давления
27. Изменение энтропии системы рассчитывают по формуле:
1) 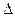 Н х.р =
Н х.р = 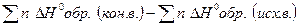 ;
;
2) 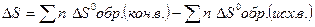 ;
;
3) 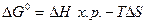 ;
;
4) 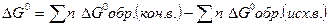
Дополните:
28. Реакции, протекающие с выделением тепла называются _____, 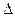 Н х.р. имеет знак __________
Н х.р. имеет знак __________
29. Химическая реакция не возможна, если _______
30. 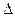 Gх.р. при н.у. рассчитывают по формуле__________, а при произвольных условиях __________
Gх.р. при н.у. рассчитывают по формуле__________, а при произвольных условиях __________
31. Если 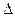 G х.р. = 0, то в системе наступает ___________
G х.р. = 0, то в системе наступает ___________
32. Если 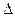 G х.р. < 0, то реакция ______________
G х.р. < 0, то реакция ______________
33. Теория электролитической диссоциации:
а) В растворе сильных электролитов больше частиц - ___________
б) Слабые электролиты количественно отличаются по величине ______
в) рН = ________
г) рН + рОН = _______
д) Математическое выражение закона разбавления Оствальда ________
е) [Н+] = 10-3, а [ОН-] = ________
ж) [ОН-] = 10-2, рН = __________
Установите соответствие:
34. КлассФормула
1) средняя соль а) PbOHNO3
2) двойная соль б) KH2PO4
3) кислая соль в) Fe2(SO4)3
4) комплексная соль г) KAl(SO4)2
5) кислота д) K3[Fe(CN)6]
6) основание е) CaOCl2
ж) H2CO3
и) Fe(OH)2
35. Среда раствора Индикатор
1) кислая а) фенолфталеин (малин.)
2) нейтральная б) метилоранж (оранж)
3) щелочная в) метилоранж (желт)
г) метилоранж (красн)
36. Диссоциация Электролиты
 1. ступенчато () а) FeOHCl2
1. ступенчато () а) FeOHCl2
 2. в одну ступень () б) Fe(OH)3
2. в одну ступень () б) Fe(OH)3
 3. ступенчато (первичная) в) KHCO3
3. ступенчато (первичная) в) KHCO3

 (вторичная) г) ZnCl2
(вторичная) г) ZnCl2
д) Na[Al(OH)4]
37. Среда раствора рН
1) нейтральная а) рН = 4
2) кислая б) рН = 7
3) щелочная в) рН = 9
г) рН = 11
38. При диссоциации электролитов образуется число ионов
 2015-01-07
2015-01-07 781
781








