Цель работы: определение степени диссоциации электролита по измерениям понижения температуры замерзания раствора.
Вещества, водные растворы которых проводит электрический ток, называют электролитами. К электролитам относятся кислоты, основания и соли, которые при растворении в воде распадаются на ионы. Распад электролитов на ионы под действием растворителя называется электролитической диссоциацией. Теория электролитической диссоциации была разработана шведским химиком С. Аррениусом. Способность растворов проводить электрический ток объясняется присутствием в растворе ионов – заряженных частиц, образующихся при взаимодействии молекул электролитов с молекулами растворителя. При этом положительно заряженные ионы притягиваются к электроду с отрицательным зарядом (катоду), их называют катионами; отрицательно заряженные ионы притягиваются к электроду с положительным зарядом (аноду), они получили название анионов. Неэлектролиты не образуют в растворе ионов.
Диссоциация электролитов представляет собой обратимый процесс. Получившиеся при диссоциации противоположно заряженные ионы, соединяются друг с другом и снова образуют молекулу, так что мы имеем одновременно и образование ионов и соединение их в молекулу.
Для каждого электролита в растворе устанавливается состояние равновесия между ионами и недиссоциированными молекулами.
Например, раствор муравьиной кислоты НСООН представляет собой такую равновесную систему:
НСООН = Н+ + НСОО-
В молярном растворе муравьиной кислоты только 2% молекул распадается на ионы, а 98% находится в виде недиссоциированных молекул.
Для того, чтобы количественно охарактеризовать диссоциацию электролита, введено понятие – степень диссоциации. Она выражается отношением числа молекул, распавшихся на ионы, к общему числу растворенных молекул. Обычно эту величину умножают на 100 и выражают степень диссоциации в процентах.
Степень диссоциации обозначают греческой буквой 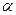 (альфа) и выражают таким образом:
(альфа) и выражают таким образом:
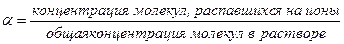
Основываясь на значении степени диссоциации, электролиты делят на сильные, средней силы и слабые.
Сильными называют электролиты, степень диссоциации которых в 0,1 Н растворе выше 30 %. Электролиты средней силы диссоциированы от 3 до 30 %. Электролиты, степень диссоциации в которых менее 3%, называют слабыми.
Сильными кислотами являются большинство кислот: HClO4, HNO3, HCl, HBr, H2SO4. Остальные неорганические кислоты (например, HNO2, H2S, H3BO3, H2CO3) и почти все органические кислоты – слабые.
Различают ещё кислоты средней силы, которые диссоциируют в значительной степени, но далеко не полностью. К ним относятся H3PO4 и H2SO3.
К сильным основаниям относятся NaOH, KOH, Ca(OH)2, Ba(OH)2 и Sr(OH)2. Слабыми основаниями являются LiOH, большинство гидроксидов двух- и трехвалентных металлов и все органические основания.
Большинство солей принадлежит к числу сильных электролитов. Исключением являются следующие растворимые в воде соли: хлорид, бромид и йодид кадмия CdCl2, CdBr2, CdI2; хлорид двухвалентной ртути HgCl2 (йодид и бромид двухвалентной ртути нерастворимы в воде); ацетат свинца Pb(CH3COO)2; роданид железа Fe(CNS)3.
В противоположность галогенидам, нитрат и сульфат кадмия и нитрат и сульфат ртути являются сильными электролитами. Соли слабых кислот, например, ацетат натрия, и соли, образованные слабыми основаниями, например, хлорид аммония, распадаются на ионы в такой же мере, как соли сильных кислот или соли, образованные сильными основаниями, т.е. они распадаются на ионы полностью.
Между концентрацией недиссоциированных молекул в растворе и концентрацией ионов, на которые распались молекулы, существует определенная зависимость.
Например, для диссоциации уксусной кислоты:
СН3СООН = Н+ + СН3СОО-
мы можем написать выражение константы равновесия:
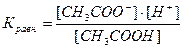
Это выражение носит название константы диссоциации. В общем виде для диссоциации электролита:
КnAm = nK+ + mA-.
константа диссоциации Кдисс определяется выражением
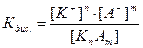 ,
,
где [K+] – концентрация катионов,
[A-] – концентрация анионов,
[KnAm] – концентрация недиссоциированных молекул.
Установлено, что константа диссоциации для слабых электролитов не меняется с изменением концентрации раствора и является постоянной величиной при постоянной температуре.
 2015-01-07
2015-01-07 962
962








