Цель работы: обнаружение ионов металлов в сухих веществах.
Химические реакции между твердыми веществами используются как метод химического анализа для определения состава различных руд и минералов. Если в исследуемой пробе анализируемый элемент присутствует в виде оксида, сульфида или карбоната, то перед проведением аналитических реакций их переводят в более реакционные соединения – хлориды или сульфаты. Для этого используют, например, хлорид аммония, который легко разлагается по реакции
NH4Cl 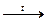 NH3 + HCl
NH3 + HCl
и заменяет соляную кислоту при взаимодействии с оксидами
Fe2O3 + 6 HCl = 2 FeCl3 + 3 H2O,
или гидросульфат калия KHSO4, который реагирует, например, с карбонатом кальция с образованием растворимых сульфатов:
CuCO3 + 2 KHSO4 = CuSO4 + K2SO4 + H2O + CO2
Скорость реакций между твердыми веществами существенно ниже, чем в растворах, поэтому ее необходимо увеличивать за счет:
- увеличения площади поверхности соприкосновения веществ путем растирания реакционной массы до порошкообразного состояния;
-постоянного перемешивания реакционной массы;
-использования малых количеств веществ (достаточно 1 мг);
- нагрева реакционной смеси (если реакция не идет при комнатной температуре).
Качественное распознание состава анализируемых веществ основано на получении окрашенных соединений элементов, входящих в его состав. При этом нередки случаи, когда несколько элементов, входящих в состав одного вещества, образуют окрашенные продукты с одним и тем же реагентом. Например, железо (III), кобальт (II) и медь (II) при взаимодействии с тиоцианатом аммония или с гексацианоферратом калия дают окрашенные роданидные комплексы.
Маскирующее действие сопутствующих элементов устраняется переводом их в неокрашенные соединения. Так, железо (III) способно образовывать прочные бесцветные фторидные комплексные соединения:
Fe3+ + 6F- = [FeF6]3-.
Ионы меди (II) маскируют добавлением в исследуемую смесь тиомочевины (NH2)2CS (Thio), с которой ионы Cu2+ образуют прочный бесцветный комплексный ион [Cu(Thio)4]2+:
Cu2+ + 4 (NH2)2CS = [Cu(Thio)4]2+,
или путем восстановления до соединений меди (I) тиосульфатом натрия Na2S2O3.
Однако, способность меди (II) восстанавливаться до меди (I) мешает определению свинца по реакции с KI. Ионы Cu2+ окисляют I- до свободного йода, который окрашивает смесь в темно-желтый (до черного) цвет, на фоне которого невозможно наблюдать окраску иодида свинца. Для устранения окраски йода в реакционную смесь вводят тиосульфат натрия Na2S2O3.
2 Na2S2O3 + I2 = Na2S4O8 + 2NaI.
В работе проводится изучение твердофазных химических реакций, позволяющих обнаружить присутствие катионов Fe3+, Co2+, Ni2+, Pb2+, Cu2+ в их соединениях.
Для определения железа (III) используются реакции:
1) с гексацианоферратом (II) калия K4[Fe(CN)6], в результате которой образуется, окрашенное в ярко-синий цвет, комплексное соединение Fe4[Fe(CN)6]3 – берлинская лазурь:
Fe3+ + [Fe(CN)6]4- = Fe4[Fe(CN)6]3 ↓
2) с тиоцианатом аммония NH4SCN, в результате которой при добавлении воды появляется кроваво-красная окраска роданидного комплекса железа (III):
Fe3+ + 6SCN- = [Fe(SCN)6]3-.
О присутствии кобальта (II) судят по реакциям:
1) с тиоцианатом аммония NH4SCN или с тиосульфатом натрия Na2S2O3 по образованию комплексных ионов кобальта ярко-синего цвета:
Co2+ + 4SCN- = [Co(SCN)4]2-,
Co2+ + S2O32- = [Co(S2O3)2]2-.
При добавлении воды эти комплексы легко разрушаются и превращаются в аквакомплекс [Co(H2O)6]2+ розового цвета;
2) с концентрированной соляной кислотой по образованию сине-фиолетового комплексного иона CoCl42-:
Co2+ + 4Cl- = CoCl42-.
Присутствие никеля (II) подтверждается реакцией с диметилглиоксимом C4H8N2O2 (реакция Л.А. Чугаева) по образованию в щелочной среде диметилглиоксимата никеля (II) малиново-красного цвета:
2 C4H8N2O2 + Ni2+ + 2OH- = C8H14N4O4Ni + H2O.
Присутствие меди (II) может быть установлено по образованию красно-бурого комплексного соединения меди (II) Cu2[Fe(CN)6] при взаимодействии с гексацианоферратом (II) калия К4[Fe(CN)6];
2Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6] ↓
Свинец (II) можно обнаружить с помощью реакций:
1) с иодидом калия по образованию золотисто-желтого иодида свинца (II):
Pb2+ + 2I- = PbI2 ↓
2) с комплексной солью олова (II) К2[SnI4] по образованию оранжево-красного комплексного соединения Pb[SnI4]:
Pb2+ + [SnI4]2- = Pb[SnI4].
 2015-01-07
2015-01-07 1091
1091








