Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики.
Дадим определение основному понятию химической кинетики – скорости химической реакции:
Скорость химической реакции определяют изменением концентрации реагирующих веществ в единицу времени, т.е
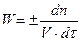 , (1)
, (1)
где V – объем системы, л; n - количество вещества к моменту времени t, моль.
В частном случае объем системы может быть принят постоянным, тогда
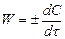 , (2)
, (2)
где С – концентрация веществ к моменту времени t, моль/л.
Скорость реакции принято считать всегда положительной, но определять её можно как по увеличению концентрации продуктов реакции (производная больше нуля), так и по уменьшению концентрации исходных продуктов (производная меньше нуля).
Основным законом химической кинетики является закон действующих масс (ЗДМ), выведенный в 1886 г. Гульдбергом и Вааге, согласно которому скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам веществ, участвующих в реакции, т.е. скорость реакции общего вида
а A + b B + d D + … ® m M + r R + …
выражается уравнением
W = kCa (A) Cb (B) Cd (D). (3)
Коэффициент пропорциональности k по своему физическому смыслу представляет собой скорость реакции при концентрациях реагирующих веществ, равных единице, и эту величину называют константой скорости. Константа скорости не зависит от концентраций реагирующих веществ, поэтому определение её величины наиболее удобно для оценки скорости данной реакции и сопоставления скоростей различных реакций. Константа скорости данной реакции зависит от температуры.
С кинетической точки зрения реакции можно классифицировать по молекулярности и порядку. Молекулярность реакции определяют числом молекул, при одновременном столкновении которых осу-ществляется элементарное химическое взаимодействие. Существуют моно-, би- и несколько тримолекулярных реакций. Реакции более высокой молекулярности практически не существует, так как одновременное столкновение более трех молекул маловероятно.
Порядок реакции определяется суммой показателей степеней в эмпирическом (полученном опытным путем) уравнении, определяющем скорость данной реакции по ЗДМ:
n = a + b + d +…
Несмотря на частные совпадения, в общем случае молекулярность и порядок не совпадают. Так, если одно или несколько веществ взяты в большом избытке, концентрация их в ходе реакции изменяется незначительно, может быть принята постоянной и должна быть исключена из числа переменных, определяющих скорость реакции. Тогда порядок реакции будет соответственно меньше её молекулярности.
 2014-05-17
2014-05-17 1957
1957








