ТЕМА: «КИНЕТИКА»
Предметами химической кинетики являются установление закономерностей, определяющих скорость химических процессов и выявление роли различных факторов, влияющих на скорость и механизм реакций.
Скорость химической реакции определяется как изменение концентрации одного из реагирующих веществ или продуктов реакции в единицу времени.
Скорость химической реакции зависит от:
· Природы реагирующих веществ,
· Концентрации реагирующих веществ,
· Температуры,
· Наличия катализатора
· Величины поверхности раздела фаз (для гетерогенных реакций)
Зависимость скорости химической реакции от концентрации
Закон действующих масс:
Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые степени.
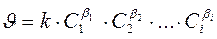 ,
,
где 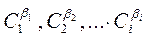 – концентрация 1, 2, … i-го реагента. Показатель степени при концентрации называется порядком реакции по данному веществу. Для простых реакций показатель степени совпадает со стехиометрическим коэффициентом в уравнении реакции. Сумма показателей степеней при концентрациях реагентов называется общим порядком реакции.
– концентрация 1, 2, … i-го реагента. Показатель степени при концентрации называется порядком реакции по данному веществу. Для простых реакций показатель степени совпадает со стехиометрическим коэффициентом в уравнении реакции. Сумма показателей степеней при концентрациях реагентов называется общим порядком реакции.
|
|
|
Например, реакция С2Н4Cl2(г) → С2Н3Cl(г) + НCl(г) является реакцией первого порядка. Закон действующих масс для данной реакции будет иметь вид:
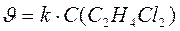 .
.
А для простой реакции 2SO2(г) + O2(г) → 2SO3(г) закон действующих масс будет иметь следующий вид:
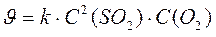
Суммарный порядок данной реакции будет равен 3 (2+1=3).
Для газообразных веществ в закон действующих масс вместо концентраций могут быть подставлены давления.
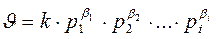
Для реакции 2SO2(г) + O2(г) → 2SO3(г) закон действующих масс выраженный через давления будет иметь следующий вид:
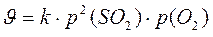
Коэффициент пропорциональности k в законе действующих масс называется константой скорости. Константа скорости химической реакции является характеристикой каждой конкретной реакции, зависит от температуры и не зависит от концентраций.
Уравнения, связывающие скорость химической реакции с концентрациями, а также выражающие зависимость концентраций от времени, называются кинетическими уравнениями. Для реакции 1-го порядка кинетическое уравнение имеет следующий вид:
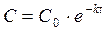 или
или 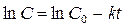 ,
,
Где С0 – начальная концентрация реагента, С – концентрация вещества в реакционной смеси к моменту времени t, k – константа скорости, t – время (с, мин, сутки, года и т.д.).
В кинетическое уравнение вместо концентраций могут быть подставлены и массы драгирующего вещества, тогда уравнение примет вид:
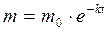 или,
или, 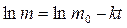
Важнейшей кинетической характеристикой является период полураспада или период полупревращения (t1/2) – время, в течение которого превращению подвергается половина взятого вещества. Для реакции первого порядка эта величина рассчитывается по формуле: 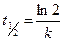
|
|
|
Задачи для самостоятельного решения:
На закон действующих масс
1. Как изменится скорость простой реакции 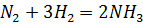 если увеличить давление в 3 раза?
если увеличить давление в 3 раза?
2. Реакция оксида азота (II) с кислородом является простой и выражается уравнением 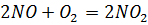 . Как изменится скорость этой реакции, если молярную концентрацию оксида азота увеличить в 2 раза, а молярную концентрацию кислорода – в 3 раза?
. Как изменится скорость этой реакции, если молярную концентрацию оксида азота увеличить в 2 раза, а молярную концентрацию кислорода – в 3 раза?
3. Взаимодействие оксида углерода (II) с хлором выражается уравнением: 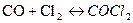 . Концентрация оксида углерода (II) равно 0,3 моль/л, а хлора – 0,2 моль/л. Как изменится скорость прямой реакции, если увеличить концентрацию оксида углерода (II) до 1,2 моль/л, а концентрацию хлора до 0,6 моль/л? Считать, что эта реакция является реакцией первого порядка по концентрациям обоих компонентов.
. Концентрация оксида углерода (II) равно 0,3 моль/л, а хлора – 0,2 моль/л. Как изменится скорость прямой реакции, если увеличить концентрацию оксида углерода (II) до 1,2 моль/л, а концентрацию хлора до 0,6 моль/л? Считать, что эта реакция является реакцией первого порядка по концентрациям обоих компонентов.
4. Скорость реакции второго порядка А+B=D равна 2,7×10-7 моль×л-1×с-1 при концентрациях веществ A и B соответственно 3,0×10-3 моль/л и 2,0 моль/л. Рассчитайте константу скорости.
5. Реакция выражается уравнением 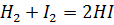 . При 508°С константа скорости этой реакции равна 0,16 л/моль×мин. Вычислите начальную скорость реакции, если исходные концентрации реагирующих веществ были с (H2)=0,04 моль/л, с (I2)=0.05 моль/л.
. При 508°С константа скорости этой реакции равна 0,16 л/моль×мин. Вычислите начальную скорость реакции, если исходные концентрации реагирующих веществ были с (H2)=0,04 моль/л, с (I2)=0.05 моль/л.
На кинетические уравнения
1. Константа скорости реакции 1-го порядка 2N2O5(г) →4NO2(г) + O2(г) при 25 ⁰С равна 3,38 10-5 с-1. Чему равен период полураспада N2O5?
2. Период полураспада радиоактивного изотопа 90Sr, который попадает в атмосферу при ядерных испытаниях, составляет 28,1 лет. Через какое время количество изотопа составит менее 1% от исходного?
3. Период полураспада радиоактивного изотопа 90Sr, который попадает в атмосферу при ядерных испытаниях, - 28.1 лет. Предположим, что организм новорожденного ребенка поглотил 1.00 мг этого изотопа. Сколько стронция останется в организме через а) 18 лет, б) 70 лет, если считать, что он не выводится из организма?
4. Разложение перекиси водорода в водном растворе является реакций первого прорядка. Константа скорости этой реакции равна 0,05081 мин-1. Определить время, за которое перекись водорода распадется на 50% и 87,5%.
5. Установлено, что реакция первого порядка С2Н4Cl2(г) → С2Н3Cl(г) + НCl(г) имеет константу скорости при 450 °С, равную 3,1. 10-3 с-1. Вычислите период полураспада. Через кокой промежуток времени в реакционной системе останется: а) 10 %; б) 30% дихлорэтана от первоначального?
6. Константа скорости реакции первого порядка 2N2O5(г) = 4NO2(г) + O2(г) при 25 °С равна 3,38×10-5с-1. Чему равен период полураспада N2O5? Какая доля N2O5 разложится за 10 с?
 2015-01-21
2015-01-21 2139
2139