Аминокислоты — это органические бифункциональные соединения, в состав которых входят карбоксильная группа —СООН и аминогруппа —NH2. В зависимости от взаимного расположения обеих функциональных групп различают ά-,β -, γ -аминокислоты и т. д.:
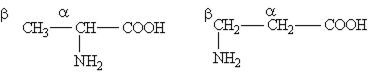
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы. Обычно рассматривают только ά-аминокислоты, поскольку другие аминокислоты в природе не встречаются.
В процессе биосинтеза белка в полипептидную цепь включаются 20 важнейших α-аминокислот, кодируемых генетическим кодом.
Общая формула α-аминокислот
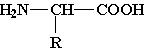
Аминокислоты можно классифицировать по нескольким признакам:
1). По способности человека синтезировать аминокислоты из предшественников:
Незаменимые: Триптофан, Фенилаланин, Лизин, Треонин, Метионин, Лейцин, Изолейцин, Валин;
Заменимые: Тирозин, Цистеин, Гистидин, Аргинин, Глицин, Аланин, Серин, Глутамин, Глутаминовая кислота, Аспарагиновая кислота, Аспарагин, Пролин
Некоторые заменимые аминокислоты синтезируются в организме человека в недостаточных количествах и должны поступать с пищей (гистидин и аргинин).
|
|
|
2). Аминокислоты делятся на протеиногенные (20 α-аминокислот) и непротеиногенные (4 аминокислоты).
3). По функциональным группам:
Алифатические моноаминомонокарбоновые: аланин, валин, глицин, изолейцин, лейцин.
Оксимоноаминокарбоновые: серин, треонин.
Моноаминодикарбоновые: аспарагиновая кислота, глутаминовая кислота. Амиды моноаминодикарбоновых: аспарагин, глутамин.
Диаминомонокарбоновые: аргинин, гистидин, лизин.
Серосодержащие: цистеин (цистин), метионин.
Ароматические: фенилаланин, тирозин.
Гетероциклические: триптофан, гистидин.
Иминокислоты: пролин (также входит в группу гетероциклических).
4). По химической природе радикаловприведены в таблице 4.
Таблица 4. Важнейшие протеиногенные аминокислоты.
| Тривиальное название | Сокращенное название | Формула |
| 1. Аминокислоты, имеющие неполярный радикал | ||
| Аланин | АЛА | 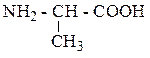 |
| Валин | ВАЛ | 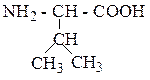 |
| Лейцин | ЛЕЙ | 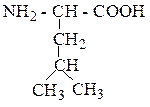 |
| Изолейцин | ИЛЕ | 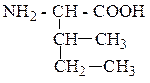 |
| Триптофан | ТРИ | 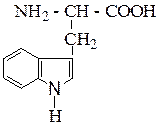 |
| Пролин | ПРО | 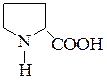 |
| Фенилаланин | ФЕН | 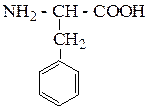 |
| Метионин | МЕТ | 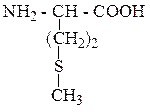 |
| 2. Аминокислоты, имеющие полярный незаряженный радикал. | ||
| Глицин | ГЛИ | 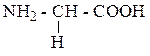 |
| Серин | СЕР | 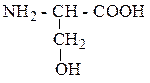 |
| Треонин | ТРЕ | 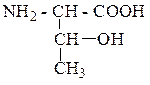 |
| Тирозин | ТИР | 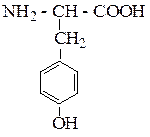 |
| Аспарагин | АСН | 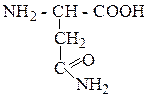 |
| Глутамин | ГЛН | 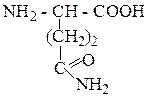 |
| Цистеин | ЦИС | 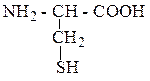 |
| 3. Аминокислоты, имеющие отрицательно заряженный радикал. | ||
| Аспарагиновая кислота | АСП | 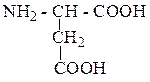 |
| Глутаминовая кислота | ГЛУ | 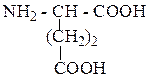 |
| 3. Аминокислоты, имеющие положительно заряженный радикал. | ||
| Лизин | Лиз | 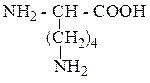 |
| Аргинин | Арг | 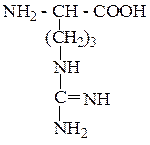 |
| Гистидин | Гис | 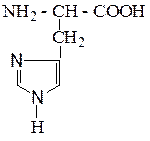 |
Важнейшие непротеиногенные аминокислоты.
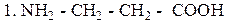 β - Аланин
β - Аланин
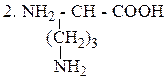 Орнитин
Орнитин
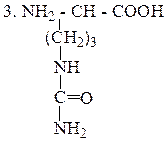 Цитруллин
Цитруллин
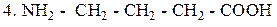 γ – Аминомасляная кислота
γ – Аминомасляная кислота
Все α-аминокислоты, кроме глицина H2N-CH2-COOH, содержат асимметрический атом углерода (α-атом) и могут существовать в виде оптических изомеров. Оптическая изомерия природных α-аминокислот играет важную роль в процессах биосинтеза белка. Типичные белки природного происхождения, состоят из L-аминокислот. D-аминокислоты и L-аминокислоты отличаются друг от друга по вкусу. Например, D-аспарагиновая кислота не имеет вкуса, а ее стереоизомер L-аспарагиновая кислота обладает мясным вкусом.
|
|
|
 2015-01-21
2015-01-21 3297
3297
